Заполнение электронных орбиталей многоэлектронных атомов
Распределение электронов в многоэлектронном атоме основано на принципе минимума энергии, принципе В.Паули, правиле Ф.Хунда и правиле Клечковского.
Принцип минимума энергии:
Электрон в первую очередь располагается в пределах электронного подуровня с наинизшей энергией.
Вначале заполняются орбитали, характеризующиеся наименьшей потенциальной энергией.
Принцип Паули:
В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми.
Следовательно, каждая орбиталь, характеризующаяся определенными значениями n, ℓ и mℓ, может быть занята не более чем двумя электронами, спины которых имеют противоположные знаки. Такие электроны называются спаренными.
Пользуясь принципом Паули, можно подсчитать, какое максимальное число электронов может находиться на каждом уровне и подуровне, т.е. определить емкость уровней и подуровней.
Количество орбиталей на подуровне определяется количеством возможных значений магнитного квантового числа, т.е. 2ℓ + 1 значение. Так как на каждой орбитали (определенное значение квантовых чисел n, ℓ и mℓ) может разместиться два электрона, обладающие разными значениями спина, то максимальное количество электронов, которое можно разместить на данном подуровне равно: 2(2ℓ + 1). Максимальное количество электронов, которое может находиться на данном уровне, характеризующемся главным квантовым числом n, равно 2n2.
Правило Хунда:
В наиболее устойчивом состоянии атома электроны размещаются в пределах электронного подуровня так, чтобы их суммарный спин был максимален. м являеисясостояниеки наиболлеронов, которое может находиться на данном уровне, характеризующимся главным квантовым числом
Так, например, у атома азота на внешнем электронном уровне находится два и три р-электрона. Здесь электроны на орбиталях изображены стрелками, направленными вверх или вниз в зависимости от знака спинового квантового числа. s-Подуровень содержит единственную орбиталь, на которой находится два электрона с противоположными спинами в соответствии с принципом Паули. В соответствии с правилом Хунда минимум энергии будет обладать конфигурация А, в которой на каждой из трех р-орбиталей будет находиться по одному электрону с одинаково направленными спинами, поэтому суммарный спин будет максимальным (±3/2), а не В, в которой суммарный спин меньше (±1/2):

Первое правило Клечковского:
Электрон обладает наинизшей энергией на той электронном подуровне, где сумма главного и орбитального квантового числа минимальна.
Е = min при n + ℓ = min
В соответствии с первым правилом Клечковского заполнение подуровней электронами происходит в порядке от подуровней с минимальным значением суммы (n + ℓ) к подуровням большими значениями n + ℓ .
Если сумма (n + ℓ) одинакова для рассматриваемых электронных подоболочек, при распределении электронов используется второе правило Клечковского:
Электрон обладает наинизшей энергией на подуровне с наименьшим значением главного квантового числа
4.5 Электронная структура атомов и периодическая система элементов
При ℓ = 0, т.е. на s-подуровне, имеется всего одна орбиталь, которую принято изображать в виде клетки. В атоме Н единственный электрон находится на самом низком из возможных энергетических состояний, т.е. на s-подуровне первого электронного слоя (на 1s-подуровне). Электронную структуру атома Н можно представить схемой:

В атоме гелия, порядковый номер которого в периодической системе (или заряд ядра Z) равен 2, второй электрон тоже находится в состоянии 1s. Электронная структура атома гелия:

У этого атома завершается заполнение ближайшего к ядру K-слоя и тем самым завершается построение первого периода системы элементов.
Рассмотренные для атомов H и He способы описания электронных оболочек называются электронно-графическими формулами (орбитали изображаются в виде клеток) и электронными формулами (подуровни обозначаются буквами, а количество электронов на них указано верхним индексом).
У следующего за гелием элемента лития (Z=3) третий электрон уже не может разместиться на орбитали K-слоя. K-слоем называется первый электронный слой атома.: это противоречило бы принципу Паули. Поэтому он занимает s-состояние второго энергетического уровня (L-слой. L-слоем называется второй электронный слой атома., n=2). Его электронная структура записывается формулой 1s22s1. Электронная структура следующих за ним бериллия и бора соответствует формуле 1s22s2 и 1s22s2р1 что соответствует электронно-графическим формулам в схеме:

Далее формирование электронных оболочек у элементов 2-го периода происходит следующим образом:
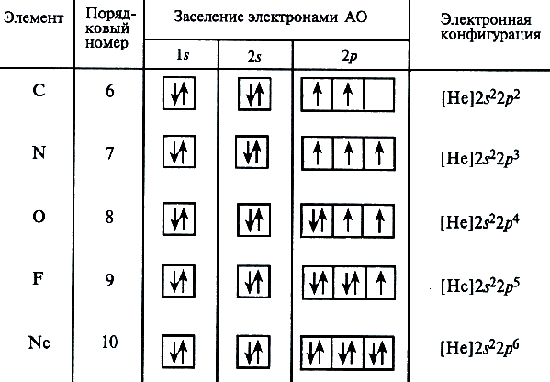
Используется сокращенная форма записи электронной структуры атома. При этом расписывается структура внешних незаполненных уровней, а вместо электронной структуры внутренних слоев в скобках указывается символ инертного газа, электронная структура которого соответствует оставшейся части электронной формулы. Так для элементов второго периода полностью заполненным является первый электронный уровень (n = 1), соответствующий атому гелия. Электронная формула в сокращенном варианте атомов: лития – [He]2s1, бериллия – щенном варианте атомаом варианте атома лития: Так для элементов второго периода полностью электронная структура кото[He]2s2, бора – [He]2s22p1.
Для атома углерода уже можно предположить три возможных схемы заполнения электронных оболочек в соответствии с электронно-графическими формулами:

Анализ атомного спектра показывает, что правильна последняя схема. Такой порядок размещения электронов в атоме углерода представляет собой частный случай общей закономерности, выражаемой правилом Хунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально. Схема электронного строения для атома азота (Z=7) представлена выше.
Затем начинается попарное размещение электронов на 2p-орбиталях. Электронные формулы остальных атомов второго периода:
O 1s22s22p4; F 1s22s22p5; Ne 1s22s22p6
У атома неона заканчивается заполнение второго энергетического уровня, и завершается построение второго периода системы элементов.
Третий период, подобно второму, начинается с двух элементов (Na, Mg), у которых электроны размещаются на s-подуровне внешнего электронного слоя. Такие элементы называются s-элементами. Говоря по-другому, они относятся к семейству s-элементов. (т.е. они относятся к s-семейству элементов). Затем следуют шесть элементов (от Al до Ar), у которых происходит формирование p-подуровня внешнего электронного слоя. Это атомы p-элементов (принадлежат к p-семейству). Структура внешнего электронного слоя соответствующих элементов второго и третьего периодов оказывается аналогичной. Иначе говоря, с увеличением заряда ядра электронная структура внешних слоев атомов периодически повторяется. Однако электронное строение атомов определяет свойства элементов и их соединений. В этом состоит сущность периодического закона: свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра.
У атома аргона остаются незанятыми все орбитали 3d-подуровня. Однако у следующих за аргоном элементов – калия и кальция – заполнение 3-го электронного слоя временно прекращается, и начинает формироваться s-подуровень 4-го слоя. Такой порядок заполнения вытекает из первого правила Клечковского. Следовательно, 4s-подуровень (n+ℓ = 4) должен заполняться раньше, чем 3d (n+ℓ = 5). Для атома скандия возникает вопрос: какой из подуровней должен заполняться – 3d или 4p, т.к. сумма n+ℓ для них одинакова и равна 5. В подобных случаях порядок заполнения определяется вторым правилом. Первое и второе правила Клечковского часто не разделяют, а считают одним совместным правилом правилом Клечковского, согласно которому при одинаковых значениях суммы (n+ℓ) орбитали заполняются в порядке возрастания главного квантового числа n. Заполнение 3d-подуровня происходит у десяти элементов от Sc до Zn. Это атомы d-элементов. Затем начинается формирование 4p-подуровня (p-элементы от Ga до Kr). Как и атомы предшествующих благородных газов – неона и аргона – атом криптона характеризуется структурой внешнего электронного слоя ns2np6.
Аналогично формируется пятый период.
В шестом периоде после заполнения 6s-подуровня начинается заполнение 4f-подуровня, и следуют атомы f-элементов. В связи с тем, что у них внешним является шестой уровень, а электроны последовательно занимают 4-й уровень, лежащий гораздо ближе к ядру, то химические свойства всех этих f-элементов близки к лантану, поэтому их часто называют лантаноидами (в 7-м периоде f-элементы называются актиноидами). После 4f заполняется 5d и, наконец, 6p-подуровень, заполнением которого заканчивается построение шестого периода. Седьмой период не завершен, т.к. элементы с большим зарядом ядра оказываются очень неустойчивыми (легко протекают ядерные реакции).
Порядок заполнения подуровней в соответствии с правилами Клечковского можно записать в виде последовательности: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s→ 5f→ 6d → 7p. Однако для некоторых элементов эта последовательность нарушается, т.е. из правил Клечковского имеются исключения. У атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место “провал” электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома, в большинстве соответствующему полностью (Cu, Pd, Ag, Pt, Au) или наполовину (Cr, Mo) заполненному d-подуровню. Например, электронная формула атома меди имеет вид: Cu 1s2 2s2 2p6 3s2 3p6 3d10 4s1, т.е. один из двух 4s-электронов “проваливается” на 3d-подуровень. Особо следует отметить палладий, у которого “проваливаются” два электрона: Pd 1s2 2s2 2p6 3s2 3p6 4s2 4p6 4d10 5s0. Второй тип исключений из правила Клечковского состоит в том, что перед заполнением 4f-подуровня один электрон располагается на 5d-подуровне: La 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f0 5s2 5p6 5d1 6s2. У следующего элемента (церия) 5d-подуровень освобождается, и оба электрона располагаются на 4f-подуровне: Ce 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f2 5s2 5p6 5d0 6s2. Аналогично, в 7-м периоде у актиния последний из электронов располагается на 6d-подуровне (а не на 5f, как должно быть по правилам Клечковского).
Дата добавления: 2021-03-18; просмотров: 664;











