Гибридизация атомных орбиталей
Из курса общей химии известно, что в соединениях трёхвалентного азота (NH3), двухвалентного кислорода (Н2О) и одновалентного галогена (HCl) в образовании ковалентных связей участвуют р-орбитали атомов N, O и Cl.
Что же касается соединений четырёхвалентного атома углерода, то не удаётся адекватно объяснить, почему неравноценные по исходному состоянию электроны (один 2s и три 2р) образуют четыре энергетически равноценные связи в СН4 или CCl4.
Если учитывать пространственную направленность, например, р-орбиталей, то можно понять, что наиболее прочная ковалентная связь образуется при таком их расположении, которое гарантирует наибольшее перекрывание.
Для четырёхвалентных атомов Лайнус Полинг предложил своеобразный компромисс, введя понятие о гибридизации атомных орбиталей.
Следует иметь в виду, что данное понятие (но не явление)используется как удобный математический приём для объяснения различных комбинаций атомных орбиталей и более удобного описания химической связи.
Итак, гибридизация – это комбинация («смешение») атомных орбиталей разных типов, но близких по энергетическому состоянию.
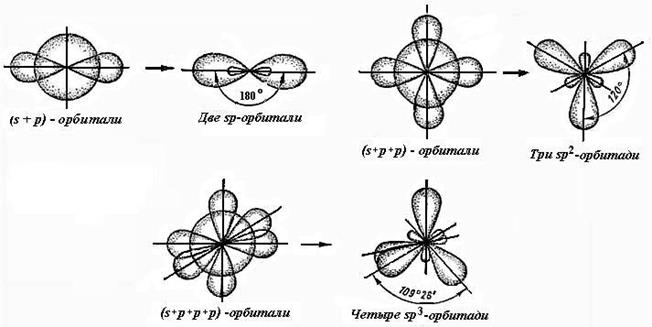
В результате гибридизации формируется набор эквивалентных, гибридных орбиталей, отличающихся от исходных как по форме, так и энергии. Так, при гибридизации одной s- и трёх р-орбиталей образуются четыре sp3-гибридные орбитали; одной s- и двух р-орбиталей – три sp2-гибридные орбитали; одной s- и одной р- - две sp-гибридные орбитали. Следовательно, число гибридных орбиталей всегда равно числу исходных негибридных орбиталей. Состояние электронов на гибридных орбиталях описывается не чистыми s-, p-, d-функциями, а смешанными, или гибридными волновыми.
На рис.2.2., показаны различные типы гибридизации атомных орбиталей.
Рисунок 2.2. Гибридизация атомных орбиталей
Необходимо отметить ряд важных особенностей, связанных с гибридизацией АО:
- гибридные орбитали позволяют пользоваться представлениями о локализованных двухэлектронных двуцентровых связях;
- связь, осуществляемая с участием гибридных орбиталей, значительно прочнее, поскольку перекрывание происходит в большей степени, чем при участии негибридных орбиталей;
- пространственная направленность гибридных орбиталей определяет геометрию молекул.
Дата добавления: 2020-10-01; просмотров: 749;











