Гибридизация – это взаимодействие атомных орбиталей с близкими значениями энергии, сопровождающееся образованием новых «гибридных» орбиталей, одинаковых по форме и энергии.
Гибридизация – процесс, требующий затрат энергии, но эти затра- ты с избытком компенсируются за счет энергии, выделяющейся при об- разовании большего числа ковалентных связей. Образующиеся «гиб- ридные» орбитали имеют форму ассимметричной гантели и отличаются от исходных орбиталей атома углерода.
Для атома углерода возможно три типа гибридизации:
· sр3-гибридизация;
· sр2-гибридизация;
· sр-гибридизация.
Гибридизация sр3-типа
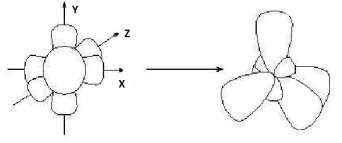
sр3-Гибридизация– это комбинация одной s- и трёх p-орбиталей внеш- него энергетического уровня и образование четырех новых sр3-орбиталей, имеющих форму объёмной восьмёрки с неравноценными сферами:
исходные орбитали sр3-гибридные орбитали
| 2p |
|
|
2s
Каждая sр3-орбиталь имеет точку с нулевой электронной плотно- стью – узел. У всех четырех орбиталей узлы совпадают – в этом месте находится ядро атома. Электронные орбитали испытывают взаимное отталкивание и отклоняются друг от друга в пространстве на макси- мально возможное расстояние. Их оси направлены к вершинам тетраэд- ра, в центре которого находится атом углерода, а угол между осями ра- вен 109°28'.
Гибридизация sр2-типа
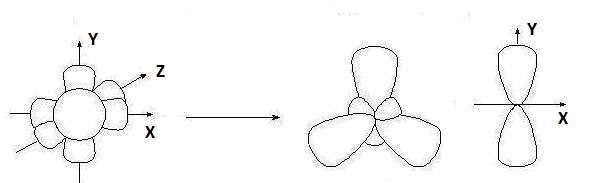
sр2-Гибридизация– это комбинация одной s- и двух p-орбиталей внешнего энергетического уровня и образование трех новых sр2-орбиталей, имеющих форму объёмной восьмёрки с неравноценными сферами:
исходные орбитали sр2-орбитали p-орбиталь
| 2p |

|
|
2s 2p
Гибридные орбитали лежат в одной плоскости, угол между их ося- ми орбиталей равен 120°. Одна p-орбиталь остается негибридизованной, и её ось перпендикулярна плоскости, в которой расположены оси трех гибридных орбиталей.
Гибридизация sр-типа
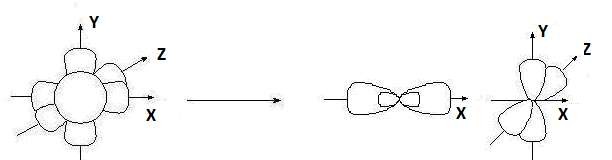
sр-Гибридизация– при этом взаимодействуют, выравниваясь по форме и энергии только две орбитали атома углерода: одна s- и одна p-. Образуются две новых sр-орбитали:
исходные орбитали sр-орбитали p-орбитали sp
| 2p |
Гибридные орбитали лежат на одной прямой, угол между их осями равен 180°, оси двух негибридизованных р-орбиталей взаимно перпен- дикулярны и перпендикулярны осям sp-орбиталей.
Гибридные орбитали атома углерода способны участвовать в обра- зовании только s-связей, незатронутые гибридизацией р-орбитали обра- зуют только p-связи. Именно этой особенностью определяется про- странственное строение молекул органических веществ.
Дата добавления: 2021-01-26; просмотров: 548;











