Вероятностная модель строения атомов. Электронные и электронно-графические формулы атомов
Вероятностная модель описывает движение электрона по отношению к ядру атома в зависимости от трех пространственных координат (r – радиус вектор, q и j - углы широты и долготы) с помощью собственных волновых функций Yn,l,m(r,q,j), удовлетворяющих уравнению Шреденгера и представляемых в виде произведения радиальной Rn,l(r) и угловой Ul,m(q,j) составляющих: Yn,l,m(r,q,j) = Rn,l(r)Ul,m(q,j). Каждая волновая функция Yn,l,m(r,q,j), называемая атомной орбиталью (АО), однозначно определяется набором из трех квантовых чисел – главного n (1, 2, 3, … µ), орбитального l [0, 1, 2, … (n-1)], магнитного m (0, ±1, ±2, … ±l) и характеризует дискретное стационарное состояние системы с определенным распределением электронной плотности в пространстве вокруг ядра, фиксированным значением энергии, момента количества движения и магнитного момента электрона.
Пример 1. Какие из наборов квантовых чисел: a) n = 3, l = 2, m = 3; б) n = 3, l = 2, m = -2; в) n = 3, l = 3, m = 2; г) n =3, l =1, m = 0; д) n = 3, l = -1, m = 0 - не имеют физического смысла и почему?
Решение. Для квантового числа n допустимыми значениями квантового числа l являются: l = (n-1), …, 0; следовательно, набор в) не имеет физического смысла. В зависимости от значения l допустимыми значениями m являются: m = -l, …, 0, …, l; следовательно, набор а) не имеет физического смысла.
Для графического отображения характера распределения электронной плотности вокруг ядра используют функцию радиального распределения электронной плотности 4pR2(r)r2dr, показывающую вероятность нахождения электрона в шаровом слое dr на расстоянии r от ядра, а также изображение электронного облака, плотность которого пропорциональна квадрату волновой функции. Электронное облако изображают в виде граничной поверхности, охватывающей 90% электронного облака. Форму и размеры граничной поверхности электронного облака считают формой и размерами атомной орбитали.
Главное квантовое число n определяет энергию электрона и положение главного максимума функции 4pR2(r)r2dr; орбитальное l – абсолютную величину момента количества движения электрона и форму атомных орбиталей, а также число максимумов (n-l) и узловых точек (n-l-1) функции 4pR2(r)r2dr; магнитное m – величину проекции момента количества движения электрона на заданное внешним магнитным полем направление и следовательно, направление атомных орбиталей в пространстве.
Атомные орбитали с постоянным значением n образуют квантовые уровни: K (n=1), L (n=2), M (n=3), N (n=4). В пределах каждого уровня орбитали с постоянным значением l образуют квантовые подуровни: s (l=0), p (l=1), d (l=2), f (l=3). Энергия электрона на атомных орбиталях подуровня постоянна и такие орбитали называются вырожденными. Число орбиталей с одинаковой энергией называется кратностью вырождения (К) Кратность вырождения атомных орбиталей подуровня – (2l+1).
| Квантовые числа | Уровень | Подуровень (К) | Атомные орбитали | ||
| N | L | M | |||
| 1, K | 1s (1) | 1s | |||
| 2, L | 2s (1) | 2s | |||
| 0, ±1 | 2p (3) | 2px, 2py, 2pz | |||
| 3, M | 3s (1) | 1s | |||
| 0, ±1 | 3p (3) | 3px, 3py, 3pz | |||
| 0, ±1, ±2 | 3d (5) | 3dxy, 3dxz, 3dyz, 3dx2-y2, 3dz2 | |||
| 4, N | 4s (1) | 4s | |||
| 0, ±1 | 4p (3) | 4px, 4py, 4pz | |||
| 0, ±1, ±2 | 4d (5) | 3dxy, 3dxz, 3dyz, 3dx2-y2, 3dz2 | |||
| 0, ±1, ±2, ±3 | 4f (7) | 4fxyz, 4fz(x2-y2), 4fy(x2-z2), 4fx(z2-y2), 4fx2-1/2xr2, 4fy2-1/2yr2, 4fz2-1/2zr2 |
Пример 2. Какие из обозначений АО не имеют физического смысла: 3f, 3d, 3pxy, 3s?
Решение. Не имеют физического смысла: 3f – поскольку для n = 3 значение l £ 2; 3pxy – поскольку нижний индекс xy используется для обозначения d-орбиталей.
Пример 3. Сколько АО могут иметь квантовые числа: а) n = 3; б) 3f; в) 3d, г) 3dxy, д) 3p, е) 3s?
Решение. а)n = 3 - третий квантовый слой содержит девять (n2) АО с различными значениями орбитального и магнитного квантовых чисел (l = 2, m = -2, -1, 0, 1, 2; l = 1, m = -1, 0, 1; l = 0, m = 0);
б) АО 3f-типа не существует - для n = 3 допустимые значения l = 0 (3s), 1 (3p) и 2 (3d);
в) 3d-подуровень содержит пять (2l+1) АО (dxy, dxz, dyz, dx2-y2, dz2) с различными магнитного квантового числа (m = -2, -1, 0, 1, 2);
г) обозначение 3dxy соответствует одной атомной орбитали с фиксированным набором разрешенных квантовых чисел n = 3, l = 2, m = 0;
д) 3p-подуровень содержит (2l+1) – три АО (px, py, pz) с различными значениями магнитного квантового числа (m = -1, 0, 1);
е) 3s – подуровень содержит одну АО с фиксированным набором допустимых значений квантовых чисел – n=3, l=0, m=0.
Пример 4. Сколько максимумов и узловых точек имеет функция радиального распределения электронной плотности для 4s АО? Какую форму имеет граничная поверхность электронного облака 4s АО?
Решение. Вид функции радиального распределения электронной плотности 4pR2(r)r2dr определяется значением главного и орбитального квантовых чисел: число максимумов – (n-l), число узловых точек – (n-l-1). Поскольку для 4s АО n = 4, l = 0, то число максимумов и узловых точек для функции 4pR2(r)r2dr составляет 4 и 3 соответственно.
Форму граничной поверхности электронного облака АО определяет значение орбитального квантового числа l. Для 4s АО l = 0, что соответствует нулевому значению абсолютной величины момента количества движения электрона и соответствует сферически симметричной форме электронного облака.
Пример 5. Определить кратность вырождения АО третьего квантового уровня и входящих в него подуровней: а) в атоме Н, б) в атоме Na.
Решение. а). Энергия АО для одноэлектронного атома водорода зависит только от значения главного квантового числа. В результате этого все (n2) девять АО третьего уровня атома водорода, входящие в состав 3s-, 3p- и 3d-орбиталей подуровней являются девятикратно вырожденными.
б). Для многоэлектронного атома натрия энергия АО зависит от значения, как главного, так и орбитального квантового числа и вырожденными являются орбитали одного подуровня: 3s (1), 3p (3), 3d (5).
Наряду с орбитальным движением вокруг ядра атома, электрон обладает собственным внутренним моментом количества движения, называемым спином. Это определяет необходимость введения в полную волновую функцию, описывающую состояние электрона в атоме и называемую атомной спин-орбиталью, спиновой x составляющей: F = Yn,l,m(r,q,j)×xs и появление четвертого спинового квантового числа ms с двумя допустимыми значениями ±1/2. С учетом спина состояние электрона в атоме характеризуется четырьмя квантовыми числами n, l, m, ms, а каждая АО Yn,l,m(r,q,j) соответствует двум состояниям электрона с различными спинами. В результате этого число различных состояний электрона в пределах квантового уровня и подуровня в два раза превышает число АО и составляет 2n2 и 2(2l+1).
Согласно принципу Паули - в атоме не может быть двух электронов, характеризующихся одинаковым набором четырех квантовых чисел. Это означает, что каждая АО может быть занята не более чем двумя электронами с различными спинами, а каждая спин-орбиталь только одним электроном.
Пример 6. Сколько электронов может содержать 2p-подуровень?
Решение. Три возможных значения магнитного квантового числа m= 0, 1, -1 определяют наличие трех АО и шести спин-орбиталей для 2р-подуровня (n = 2, l = 1). Следовательно, в соответствии с принципом Паули электронная емкость 2р-подуровня соответствует шести электронам.
Основному (невозбужденному) состоянию атома отвечает распределение электронов по АО, соответствующее минимальной энергии атома. Порядок заполнения электронами АО, отвечающий основному состоянию многоэлектронных атомов, определяется правилами:
Клечковского - АО заполняются электронами в порядке последовательного увеличения суммы главного и орбитального квантовых чисел n+l, а при одинаковых значениях этой суммы – в порядке последовательного возрастания главного квантового числа n;
и Хунда – минимальной энергии атома соответствует распределение электронов по АО подуровня, при котором абсолютное значение суммарного спина атома максимально. Следствием из правила Хунда является – повышенная устойчивость электронных конфигураций атомов, характеризующихся наполовину и полностью заполненными электронами АО подуровня.
Пример 7. Какой подуровень заполняется электронами в атоме после заполнения 4р-подуровня?
Решение. Подуровню 4р соответствует сумма n+l = 4+1 = 5. Такой же суммой n+l характеризуются подуровни 3d (3+2=5) и 5s (5+0=5). Однако состоянию 3d отвечает меньшее значение n, чем состоянию 4p; поэтому подуровень 3d будет заполняться раньше, чем подуровень 4р. Следовательно, после заполнения 4р будет заполняться подуровень 5s.
Для записи электронных конфигураций атомов используют электронные и электронно-графические формулы. Полная электронная формула атома химического элемента – последовательность полностью или частично заполненных электронами подуровней в порядке возрастания главного квантового числа с указанием в виде верхнего правого индекса числа электронов на подуровне – например, P 1s22s22p63s23p3. Для более компактной записи электронных формул внутренние полностью заполненные электронами уровни изображают в виде символа соответствующего благородного газа в квадратных скобках, – например, P [Ne]3s23p3, или используют сокращенные электронные формулы, отражающие распределение электронов только на внешних валентных орбиталях – P 3s23p3. Для отображения характера распределения электронов по АО с учетом их спина используют полные и сокращенные электронно-графические формулы – каждую орбиталь изображают в виде квантовой ячейки, а электрон – в виде стрелки, направление которой отражает спин электрона. Расположение квантовых ячеек по вертикали соответствует их относительной энергии.
Пример 8. Написать электронные и сокращенные электронно-графические формулы атомов азота, ванадия и неодима в основном состоянии.
Решение. Основному состоянию атомов с минимальной энергией отвечает распределение электронов по атомным орбиталям соответствующее правилам Клечковского и Хунда. Электронные формулы: в соответствии с порядковым номером 7 электронов азота распределяются по АО первого и второго квантовых уровней – N 1s22s22p3, или N [He]2s22p3; порядковый номер ванадия 23 определяет распределение его электронов по АО с первого по четвертый квантовый уровень - V 1s22s22p63s23p63d34s2, или V [Ar]3d34s2; неодим имеет порядковый номер 60 и характеризуется распределением электронов по АО с первого по шестой уровень – Nd 1s22s22p63s23p63d104s24p64d104f46s2, или Nd [Xe]4f46s2. Сокращенные электронно-графические формулы:
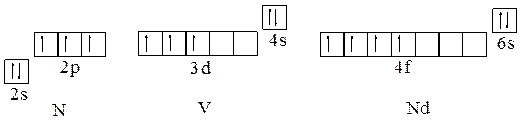 |
Пример 8. Какие из состояний р-элементов IV-группы, описываемых схемами:
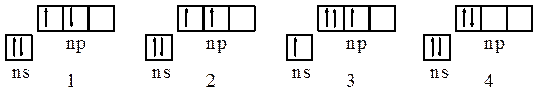
и почему соответствуют состоянию атомов в основном состоянии, в возбужденном состоянии и принципиально невозможны?
Решение. Для атомов р-элементов IV-группы: 2) – основное состояние, отвечающие в соответствии с правилом Хунда минимальной энергии атома, 1) и 4) – возбужденные состояния, не соответствующие правилу Хунда, 3) – принципиально невозможное состояние, противоречащее принципу Паули.
Пример 9. Используя сокращенные электронные формулы, записать переходы: Se2-®Se®Se4+®Se6+, Cr®Cr2+®Cr3+®Cr6+. Записать сокращенные электронно-графические формулы ионов: Se4+, Cr2+, Cr3+.
Решение: Селен Se 4s24p4 и хром Cr 3d54s1 относятся к р- и d-элементам VI группы 4 периода. Переходы между различными степенями окисления селена происходят с участием 4s- и 4р-валентных электронов, а для хрома – 3d- и 4s-валентных электронов:
Se2- (4s24p6) ® Se (4s24p4) ® Se4+ (4s2) ® Se6+ ([Ar]);
Cr (3d54s1) ® Cr2+ (3d4) ® Cr3+ (3d3) ® Cr6+ ([Ar]).
Электронной-графические формулы Se4+, Cr2+, Cr3+:
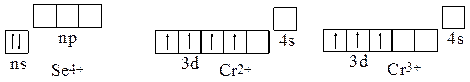 |
Упражнения:
30. Какие из состояний атома водорода: 2p, 3s, 1s, 4dxy, 2px являются: а) основным, б) возбужденным, в) вырожденным (укажите кратность вырождения).
31. От каких квантовых чисел зависят радиальная и угловая составляющая волновой функции электрона в атоме водорода? Какие значения они могут принимать? Какие из наборов квантовых чисел являются разрешенными: а) n = 3, l = 1, m = -1; б) n = 3, l = 1, m = 2; в) n = 2, l = 2, m = 0; г) n = 9, l = 0, m = 0; д) n = 4, l = -2, m = 1?
32. Как обозначают атомные орбитали с определенным набором квантовых чисел? Какие из обозначений атомных орбиталей не имеют физического смысла: 4f, 2d, 2sxy, 5p, 1p, 3f, 3dyz?
33. Чем отличаются атомные орбитали и физические параметры движения электрона в следующих состояниях: а) 2p и 3р; б) 3s, 3p и 3d; в) 3px, 3py и 3pz; г) 3dxy и 3dx2-y2?
34. Сколько атомных орбиталей могут иметь квантовые числа: а) n = 4; б) 4p; в) 3d; г) 3f, д) 3dxy?
35. Каково соотношение между номером квантового уровня и числом – подуровней и атомных орбиталей уровня? Чему равна кратность вырождения атомных орбиталей третьего уровня для иона Li2+ и атома Li?
36. Укажите значения квантовых чисел n, l и m для всех орбиталей, входящих: а) в 4f-подуровень; б) во второй квантовый уровень. Определите кратность вырождения орбиталей четвертого квантового уровня и каждого из входящих в него подуровней для: 1) атома Н, 2) атома Cs.
37. Расположите в порядке возрастания энергии фотонов, требуемых для перехода электрона из одного состояния в другое: 1) 1s®2p, 1s®2s; 2) 2s®3s, 2s®3p, 2s®3d, 2s®4s; 3) 3p®3d, 3p®4s, 3p®4p, 3p®4d, 3p®4f, 3p®5s для атома – а) H, б) K.
38. Определите число максимумов и узловых точек функции радиального распределения электронной плотности для валентных электронов следующих атомов: H, B, P, Cr, Nd.
39. Каково соотношение между значениями главного и орбитального квантовых чисел и числом максимумов и узловых точек функции радиального распределения электронной плотности? На каком расстоянии от ядра наиболее вероятно нахождение электрона в основном состоянии, первом, втором и третьем возбужденных состояниях атома водорода?
40. Как изменяется положение максимумов функции радиального распределения электронной плотности при переходе от атома водорода к водородоподобным ионам: а) He+, б) Li2+, в) Be3+?
41. Приведите изображение граничных поверхностей валентных электронных облаков атомов: Li, B, Sc.
42. Какую характеристику электрона отражает спиновое квантовое число? Какие значения оно может принимать? Сколько состояний может иметь электрон в пределах атомных орбиталей подуровня и квантового уровня?
43. Как и почему изменяется величина константы экранирования и эффективный заряд ядра для 1s-, 2s-, 3s-, 3p-, 3d- и 4s-электронов в атоме Sc?
44. Какие из состояний р-элементов V-группы:
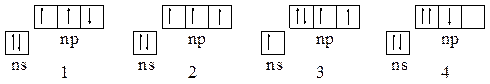 |
и почему соответствуют состоянию атомов в основном состоянии, в возбужденном состоянии и принципиально невозможны?
45. Какое следствие вытекает из правила Хунда и как оно влияет на характер распределения электронов между валентными ns-/(n-1)d- и ns-/(n-2)f-орбиталями для атомов переходных химических элементов? Для каких элементов периодической системы наблюдается явление “проскока” валентных электронов?
46. Записать сокращенные электронные и электронно-графические формулы: S, S2-, S4+, S+6, Bi, Bi3+, Cr, Cr2+, Nd, Nd3+.
47. Используя сокращенные электронные формулы, записать переходы: Cl-®Cl®Cl+®Cl3+®Cl5+®Cl7+, Mn®Mn2+®Mn4+®Mn6+®Mn7+. Записать электронно-графические формулы: Cl3+, Mn2+, Mn4+.
48. Для каких элементов периодической системы: s, p, d, f - и почему основное состояние атомов часто не согласуется с правилом Клечковского?
Дата добавления: 2016-06-22; просмотров: 3912;











