Модель Бора электронного строения атома водорода и водородоподобных ионов
Модель Бора электронного строения одноэлектронных водородоподобных систем основана на планетарной модели Резерфорда и двух постулатах:
- движение электрона вокруг положительно заряженного ядра атома без излучения им электромагнитной энергии может происходить только по дискретным стационарным орбитам, удовлетворяющим условию равенства момента количества движения электрона целому числу квантов действия: mevr = nh/2p, где me и v – масса и скорость движения электрона, r – радиус стационарной орбиты, h – постоянная Планка, n – квантовое число, имеющее целочисленные значения: 1, 2, 3,… µ;
- излучение или поглощение квантов энергии происходит при переходе электрона с одной стационарной орбиты на другую: hn = DE, где DE – энергетическая разность состояния электрона на стационарных орбитах.
Модель Бора позволила получить основные характеристики движения электрона в электрическом поле положительно заряженного ядра атома – величину радиуса стационарных орбит, скорости и полной энергии электрона:
r = n2h2/(4p2mee2),
v = 2pe2/(nh),
E = -2p2mee4/(n2h2)
и обосновать линейчатый характер спектров излучения и поглощения атомов водорода:
hn = DE = (2p2mee4/h2)(1/ni2 – 1/nj2),
где ni и nj – квантовые числа стационарных орбит.
Пример 1. Определите радиус, скорость движения и энергию электрона в атоме водорода на второй боровской орбите.
Решение. Движение электрона на второй боровской орбите соответствует значению квантового числа n = 2. Поскольку me= 9.1×10-31 кг, e- =1.6×10-19 Кл и h =6.626×10-34 Дж×с, то для второй боровской орбиты:
r = (2×6,626×10-34)2/[4×(3,14)2×9,1×10-31×(1,6×10-19)2] = 2.16×10-10 м = 2.16 Å,
v = (2×3,14×6,626×10-34)/(2×6,626×10-34) = 4.37×106 м×с-1,
E2 = -2(3,14)2×9,1×10-31×(1,6×10-19)4/(2×6,626×10-34)2 = -2.176×10-18 Дж.
Пример 2. Определить третий потенциал ионизации атома лития.
Решение. Атом Li состоит из ядра с Z = +3 и трех электронов. Третий потенциал ионизации (ПИ3) атома Li соответствует энергии, необходимой для удаления электрона от водородоподобного иона Li2+:
Li2+ = Li3+ + e-.
Для описания движения электрона в таких водородоподобных системах могут быть использованы соотношения аналогичные уравнениям для атома водорода, но с учетом действия на электрон кулоновского притяжения к ядру с зарядом Z:
r = n2h2/(4p2meZe2),
v = 2pZe2/(nh),
E = -2p2meZ2e4/(n2h2).
Значение третьего потенциала ионизации Li по абсолютной величине равно энергии электрона, находящегося в ионе Li2+ на первой (n=1) боровской орбите:
ПИ3 =2p2meZ2e4/(h2)=2(3.14)2×9.1×10-31×(3)2×(1.6×10-19)4/(6.626×10-34)2 =1.96×10-17 Дж.
Пример 3. Определить квантовое число n возбужденного состояния атома H, при переходе из которого в основное состояние в спектре испускания возникает линия с волновым числом 97492,208 см-1.
Решение. Испускание атомами H квантов электромагнитного излучения с энергией E = hc/l происходит при переходе электрона между стационарными орбитами с различными значениями квантового числа n:
hc/l = E(ni)– E(nj) = (2p2mee4/h2)×[1/nj2 – 1/ni2]
Поскольку основному состоянию отвечает значение n = 1, то энергия квантов с волновым числом 1/l соответствует энергетическому различию между состоянием электрона на стационарных орбитах с nj= 1 и ni = n:
1/l = (2p2mee4/h3c)×(1/12 – 1/n2).
Величина 2p2mee4/h3c соответствует постоянной Ридберга RH:
RH = 2p2mee4/h3c = 109677.581 см-1
Таким образом, появление спектральной линии с волновым числом 97492,208 см-1 в спектре испускания атомов водорода связано с переходом электрона из возбужденного состояния с квантовым числом n в основное состояние:
109677,581(1/12 – 1/n2) = 97492.208, n = 3.
 Упражнения:
Упражнения:
11. Сравните энергию, скорость движения электрона на четвертой боровской орбите и ее радиус по сравнению с первой боровской орбитой атома водорода.
12. Определите потенциал ионизации атома водорода.
13. Определите второй потенциал ионизации атома гелия.
14. Серия Бальмера в спектре испускания атомов Н образуется за счет переходов электрона на вторую боровскую орбиту. Определить, какие из линий серии Бальмера попадают в видимую часть спектра от 400 до 750 нм.
15. Определите наиболее высоко энергетические линии, наблюдаемые в спектре атомов водорода для серии Бальмера, Лаймена, Пашена, Бреккета и Пфунда.
16. Определите энергию возбуждения электрона в атоме натрия, если его пары поглощают фотоны с длиной волны 434 нм.
17. Определите энергетические переходы электрона атома водорода, соответствующие красной (l = 656 нм) и голубой (l = 486 нм) линии в спектре испускания атомарного водорода.
18. Каким линиям в спектре отвечает излучение водорода при переходе электрона из одного энергетического состояния в другое со следующими начальными и конечными значениями главного квантового числа: а) n = 4 и 2; б) n = 2 и 1; в) n = 3 и 2? Какой области электромагнитного спектра отвечают эти линии?
Волны материи
В соответствии с современными представлениями любые материальные объекты характеризуются наличием и корпускулярных и волновых свойств, взаимосвязь между которыми определяет уравнение де Бройля: l = h/(mv), где m и v – масса и скорость движения материального объекта, характеризующие его корпускулярные свойства, а l - длина волны, отражающая волновые свойства объекта.
Пример 1. Определите энергию фотона в джоулях и электрон-вольтах, соответствующего красной границе видимого света (l = 750 нм). Чему равна энергия таких фотонов, выраженная в джоулях на моль?
Решение. По уравнению Планка энергия фотона с длиной волны l:
Е = hn = hc/l = 6.626×10-34×3×108/750×10-9 = 2.65×10-19 Дж
Поскольку 1эВ = 1.602×10-19 Дж, то в электрон-вольтах энергия фотона составляет Е = 1.65 эВ. Энергия одного моля таких фотонов:
Е = NA×2.65×10-19 = 6.023×1023×2,65×10-19 = 1.6×105 Дж/моль.
Пример 2. Определите длину волны электрона, движущегося со скоростью 2×108 м/c.
Решение. С учетом значений массы и скорости движения электрона: me = 9.1×10-31 кг, v = 2×108 м/с, длина волны электрона в соответствии с уравнением де Бройля:
l = 6.626×10-34/(9.1×10-31×2×108) = 3.6×10-12 м.
Пример 3. Определите массу и энергию фотона, соответствующую появлению в спектре атомарного водорода наиболее длинноволновой линии серии Бальмера.
Решение. Наиболее длинноволновая (низкоэнергетическая) линия серии Бальмера возникает в результате перехода электрона с третьего на второй энергетический уровень:
hc/l = (2p2mee4/h2)×(1/22 – 1/32)
l = hc/[(2p2mee4/h2)×(1/22 – 1/32)] = 6.563×10-7 м
Из уравнения де Бройля это соответствует массе движущегося со скоростью света (с = 3×108 м/с) фотона:
m = h/lc = 6.6262×10-34/(6.536×10-7×3×108) = 3.3×10-36 кг.
Энергия фотона с l=6.536×10-7 м определяется уравнением Планка:
Е = hn = hc/l = 6,6262×10-34×3×108/6,536×10-7 = 3×10-19 Дж.
Одним из экспериментальных подтверждений наличия у электромагнитного излучения не только волновых, но и корпускулярных свойств является фотоэффект – испускание металлами электронов при освещении их электромагнитным излучением, частота которого больше некоторого порогового значения (красной границы фотоэффекта). В соответствии с квантовой теорией Эйнштейна, при освещении поверхности металла электромагнитным излучением, представляющим собой поток фотонов с энергией E = hn, происходит передача энергии фотонов электронам металла, которые вылетают из металла с кинетической энергией (mv2/2), равной разности энергии падающих фотонов и энергии выхода (W) электронов из кристаллической решетки металла:
mv2/2 = hn - W.
Пример 4. Определите красную границу фотоэффекта для цезия, если работа выхода электрона из цезия составляет 1.9 эВ.
Ращение. В соответствии с уравнением Ейнштейна:
hn = hc/l = W + mv2/2
максимальная длина волны, соответствующая красной границе фотоэффекта, определяется равенством энергии фотонов и работы выхода электрона W из материала фотокатода hc/l = W:
l = hc/W = 6.626×10-34×3×10-8/(1.9×1.602×10-19) = 6.53×10-7 м = 653 нм.
Фундаментальным принципом природы, лежащим в основе современных представлений о корпускулярно-волновой двойственности материальных объектов, является принцип неопределенности Гейзенберга – невозможно сколь угодно точно одновременно определить положение и импульс материального объекта:
D q×Dp 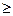 h/2p,
h/2p,
где Dq – неопределенность положения объекта в пространстве (его координат), а Dp – неопределенность импульса (р = mv) объекта.
Пример 5. Определите относительную неопределенность в положении электрона в атоме водорода при движении его по первой боровской орбите, если относительная точность определения его скорости составляет 1%.
Решение. В соответствии с принципом неопределенности:
Dq×Dp 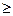 h/2p или Dq×Dv
h/2p или Dq×Dv 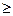 h/2pme.
h/2pme.
Поскольку скорость электрона на первой (n=1) боровской орбите:
v1 = (h/2p)(1/mer1),
то из условия задачи следует:
Dv = 0,01v1 = 0,01(h/2p)(1/mer1)
Подставляя выражение для Dv в соотношение Гейзенберга, получим:
Dq×0,01(h/2p)(1/mer1) 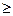 h/2pme,
h/2pme,
Dq/r1 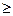 100
100
Tаким образом, величина неопределенности в положении электрона на боровской орбите составляет более 10000%, что указывает на принципиальную невозможность описания его движения по фиксированным орбитам.
Упражнения:
19. Определите скорость движения электрона, если его длина волны составляет 2.42×10-8 м.
20. Масса фотона равна массе электрона (9.1×10-31 кг). Какова длина волны этого фотона?
21. Определите длину волны нейтрона (m = 1.675×10-27 кг), движущегося со скоростью 4×102 м/с.
22. С какой скоростью должна двигаться a-частица, чтобы ее длина волны составляла 2×10-12 м?
23. Определите длину волны молекулы фтора, движущейся со скоростью 500 м/с. Можно ли экспериментально наблюдать волновые свойства такой молекулы фтора?
24. Какую энергию необходимо сообщить невозбужденному атому водорода, чтобы он мог испускать излучение с l = 1.5×10-7 м?
25. Определите энергию фотонов в джоулях, электрон-вольтах и джоулях на моль, соответствующих синей границе видимого света l = 400 нм.
26. Радиостанция ведет передачи на частоте 1120 кГц. Какова длина волны и энергия фотона такого излучения?
27. Определите величину скорости движения фотоэлектрона, образующего при освещении цезиевого фотокатода видимым светом с длиной волны 450 нм, если работа выхода электрона из цезия равна 1.9 эВ.
28. Металлический литий испускает электроны под воздействием излучения с длиной волны не более 520 нм. Определить работу выхода для лития. Какова кинетическая энергия электронов, испускаемых литием при освещении его светом с l = 360 нм?
29. Вывести общее соотношение, связывающее относительные неопределенности в скорости движения электрона (xv = Dv/v) по боровской орбите и его положения (xq = Dq/r) на орбите.
Дата добавления: 2016-06-22; просмотров: 2761;











