О структуре двуокиси титана, получаемой при взаимодействии тетрахлорида титана с кислородом
В последнее время хлорный способ производства двуокиси титана получил широкое развитие в мировой практике, однако в периодической литературе имеется мало сведений о технологических параметрах процесса взаимодействия четыреххлористого титана с кислородом и механизме образования рутильной или анатазной модификации двуокиси титана. Известно лишь несколько работ, касающихся этого вопроса.
Так, в работе отмечается, что при взаимодействии тетрахлорида титана с кислородом в интервале 700—800 °С образуется анатазная двуокись титана, при 1000— 1200 °С — смесь анатаза и рутила, причем содержание последнего возрастает с повышением температуры в реакторе. В монографии Хазина также указывается на первичный характер образования анатаза, который в дальнейшем, в зависимости от условий проведения реакции, стабилизируется или переходит в рутил.
Чехословацкие исследователи отмечают, что решающее влияние на кристаллическую структуру оказывает температура реакции взаимодействия и продолжительность выдержки продуктов реакции в зоне высоких температур. В патентной литературе содержатся противоречивые сведения о параметрах этого процесса.
Проведенный нами термодинамический анализ реакции взаимодействия четыреххлористого титана с кислородом показал (рис. 1), что изменение свободной энергии образования рутильной модификации имеет значительно более отрицательную величину, свидетельствующую о большей вероятности образования продукта рутильной структуры.

Рис. 1. Изменение свободной энергии образования рутила и анатаза в зависимости от температуры
Процесс превращения анатаза в рутил изучался многими авторами, которые показали, что скорость превращения зависит от условий получения анатаза, температуры и времени выдержки. Этот процесс хорошо описывается уравнением Аррениуса и его энергия активации имеет довольно большое значение - 100—120 ккал/моль, свидетельствующее о том, что скорость процесса превращения в основном зависит от температуры.
С целью выяснения влияния технологических параметров процесса и проверки вышеизложенных положений нами и были проведены лабораторные исследования.
Опыты проводили на лабораторной установке, состоящей из реактора сжигания, нагревателя кислорода, испарителя и перегревателя четыреххлористого титана, которые были изготовлены из кварцевого стекла и нагревались с помощью электрических печей сопротивления. Расход четыреххлористого титана и кислорода измеряли ротаметрами типа РС-3, температуру подогрева исходных реагентов и реактора сжигания — термопарами.
Различное время пребывания исходных компонентов и продуктов реакции в обогреваемом реакционном аппарате достигалось путем изменения расхода тетрахлорида титана и кислорода, диаметра и длины реактора. Кристаллическую структуру получаемой двуокиси титана определяли на аппарате УРС50-ИМ.
Опыты проводили в интервале температур 700—1300 °С при расходе четыреххлористого титана от 5 до 50 г/мин, температуре подогрева исходных реагентов 500—1300 °С и различном времени пребывания в реакционном аппарате.
На рис. 2 представлены данные по изменению содержания рутила в двуокиси титана в зависимости от расхода тетрахлорида титана при температуре подогрева исходных реагентов и реактора сжигания 1000 °С. Поскольку все опыты проводили в реакторе одинакового объема, время пребывания зависело в основном от расхода реагентов и было в пределах от 2—3 до 20—25 с.

Рис. 2. Изменение содержания рутила в зависимости от расхода тетрахлорида титана
Пониженное содержание рутила в двуокиси титана при расходе ТіСl4 5—10 г/мин и большем времени выдержки свидетельствует о том, что в данном случае не наблюдается заметного превращения анатаза в рутил и процесс превращения не играет существенной роли в изменении содержания рутила в конечном продукте. Очевидно,, при указанной температуре определяющим фактором является время химического взаимодействия (длина факела горения).
Для проверки этого предположения были проведены опыты с различной температурой подогрева исходных реагентов (500— 1300 °С) при расходе ТіСl4 5, 20 и 40 г/мин и температуре в реакторе 1000 °С (рис. 3). Поскольку процесс взаимодействия в интервале температур 600—1100 °С протекает в кинетической области и его скорость в основном определяется температурой, то с повышением последней можно ожидать увеличения скорости протекания процесса (сокращения длины факела горения).
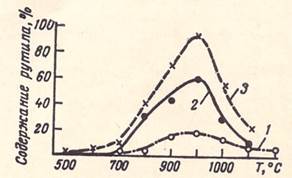
Рис. 3. Влияние температуры подогрева исходных компонентов на кристаллическую структуру двуокиси титана. Расход ТіСl4 5 (1), 20 (2) и 40 (3) г/мин
При 500—700 °С двуокись титана имеет структуру анатаза (при всех исследованных расходах ТіСl4 и времени пребывания продукта в горячей зоне от 2,0—3,0 до 20—25 с). С увеличением температуры до 1000 °С содержание рутила в получаемом продукте возрастает, причем большему расходу ТіСl4 отвечает более высокое содержание рутила.
Дальнейшее повышение температуры нагрева реагентов приводит к снижению содержания рутила. Из приведенных данных следует, что температура начала взаимодействия и время химического взаимодействия (длина факела горения) оказывают решающее влияние на кристаллическую структуру получаемой двуокиси титана.
При температуре подогрева исходных реагентов 500—700 °С в начальной стадии взаимодействия образуются зародыши анатазной модификации и хотя реагенты в дальнейшем и нагреваются в реакционном аппарате до температуры 1000 °С, кристаллизация вновь образующихся частиц ТiO2 идет уже на ранее сформировавшихся зародышах анатазной структуры. При повышении температуры подогрева до 1000 °С в начальной стадии взаимодействия, очевидно, образуются зародышевые кристаллы как анатазной, так и рутильной модификации.
Однако количество рутила в конечном продукте будет определяться условиями дальнейшего протекания химической реакции и в первую очередь — скоростью горения и связанной с ней длиной факела. При малом расходе реагентов (см. рис. 2 и 3) факел горения имеет небольшую длину и образовавшиеся в начальный момент зародыши рутила и анатаза незначительно изменяют свое соотношение.. Увеличения содержания рутила за счет превращения анатаза также не наблюдается, хотя время пребывания в этом случае составляет 20—25 с.
При увеличении расхода ТіСl4 до 30—40 г/мин факел горения удлиняется, зона химического взаимодействия растягивается по длине реакционного аппарата и наличие в начальной стадии взаимодействия зародышевых кристаллов более устойчивой кристаллической модификации (рутила) способствует кристаллизации вновь образующихся молекул двуокиси титана на зародышевых кристаллах рутильной структуры.
Рост зародышей после достижения критического размера сопровождается уменьшением свободной энергии системы, в то время как образование зародыша и его рост до критического размера протекают при увеличении свободной энергии системы. И хотя в процессе химического взаимодействия в результате флуктуации и могут возникать новые зародыши, вероятность того, что система перейдет в исходное состояние и они исчезнут, очень велика, т. е. термодинамически более возможен процесс роста первоначально образовавшихся зародышей, чем возникновение новых.
Эти представления о зародышеобразовательном механизме подтверждаются тем, что с увеличением расхода ТіСl4 (при прочих равных условиях) происходит значительное снижение степени дисперсности. Такой же механизм, очевидно, наблюдается при введении небольших количеств (1,0— 2,0%) рутилирующих добавок (паров воды, низших хлоридов титана и др.), которые в процессе взаимодействия образуют зародышевые кристаллы рутила, в результате чего и удается получить двуокись титана рутильной структуры при температуре процесса 1000—1100 °С.
С увеличением температуры подогрева исходных реагентов до 1200—1300 °С при всех указанных расходах ТіСl4 снова значительно падает содержание рутила, хотя при указанных температурах в начальной стадии взаимодействия образуются зародышевые кристаллы рутила и анатаза.
Снижение содержания рутила в этом случае происходит за счет сокращения зоны химического взаимодействия (длины факела горения) вследствие увеличения скорости взаимодействия при повышении температуры подогрева исходных компонентов, что соответствует данным, приведенным на рис. 2, для расходов ТіСl4 5—10 г/мин.
С целью выяснения зависимости кристаллической структуры получаемой двуокиси титана от продолжительности выдержки продуктов реакций при различных температурах и исключения влияния теплового эффекта реакции на температуру реакционной зоны была проведена серия опытов при расходе ТіСl4 5—10 г/мин (рис. 4).
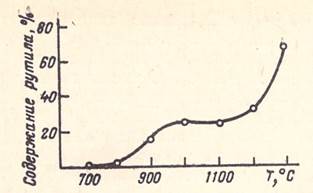
Рис. 4. Влияние температуры процесса на кристаллическую структуру двуокиси титана
Опыты проводились при одинаковых температурах подогрева исходных компонентов и реакционного аппарата при времени выдержки 35—40 с. На приведенной кривой можно выделить три температурные области. Первая относится к температуре процесса 700— 800 °С. В этих условиях образуется двуокись титана только анатазной структуры.
Во второй области при 900—1100 °С наблюдается повышение содержания рутила до 20—25%. При этом, очевидно, в начальной стадии взаимодействия образуются зародышевые кристаллы как анатазной, так и рутильной модификации. Практически одинаковое содержание рутила в интервале температур 1000—1100 °С свидетельствует о том, что превращения анатаза в рутил при указанных температурах и времени пребывания в течение 35—40 с не происходит.
В третьей области при 1200—1300 °С наблюдается дальнейшее повышение содержания рутила в ТiO2 до 65—70%, очевидно, вследствие возрастания скорости процесса превращения анатаза в рутил.
Дата добавления: 2024-06-08; просмотров: 463;











