ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ. ЭНТРОПИЯ.
Все процессы, протекающее в природе, подчиняются первому закону термодинамики, однако не всякий возможный процесс осуществим на практике. Исходя из первого закона, нельзя решить, происходит ли самопроизвольно переход теплоты от нагретого тела к холодному или наоборот, т.е. нельзя определить направление самопроизвольного процесса (процесса, происходящего спонтанно без внешних воздействий).
Второй закон термодинамики позволяет предсказать направление процесса при заданных условиях. В отличие от первого закона термодинамики он не носит всеобщего характера, и применим лишь к системам, состоящим из большого числа частиц.
Открытию второго закона термодинамики предшествовало изобретение тепловых машин – устройств, которые могут превращать теплоту в работу. Естественность хаотического движения молекул приводит к тому, что теплоту нельзя полностью превратить в работу. А работу можно полностью превратить в теплоту – это принципиальное отличие теплоты от работы.
Любой химический процесс можно представить как совокупность двух явлений: во-первых, передачи энергии, во-вторых, изменение упорядоченности во взаимном расположении частиц. Качественно охарактеризовать рассеивание тепловой энергии призвана энтропия, которая обозначается символом S. Энтропия – мера неупорядоченности системы. При переходе системы из более упорядоченного состояния в менее упорядоченное состояние энтропия системы возрастает, а при переходе системы из менее упорядоченного в более упорядоченное состояние энтропия системы уменьшается.
Существует несколько формулировок второго закона термодинамики:
1. Формулировка по Клаузиусу. Теплота не может самопроизвольно переходить от более холодного тела к более горячему.
2. Формулировка по Оствальду. Вечный двигатель второго рода невозможен (т.е. не существует машины, которая бы полностью превращала теплоту в работу).
3. Формулировка по Томсону. Невозможно получать работу при наличии только одного источника тепла в циклически действующей машине.
В тепловых машинах вещество (рабочее тело) совершает цикл процессов, возвращаясь в исходнее состояние. Простейшим примером является цикл Карно (рабочее тело – идеальный газ), который состоит из двух изотерм и двух адиабат. Используя цикл Карно, можно доказать, что приведенная теплота Q/T обладает свойствами функции состояния. Энтропия также является функцией состояния (так как число способов, которыми можно реализовать то или иное состояние, не зависит от пути перехода в него) и её изменение в любом равновесном (обратимом) процессе равно приведённой теплоте:
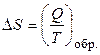 , (2.1)
, (2.1)
или
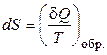 . (2.2)
. (2.2)
Следует учитывать, что для необратимых процессов приведённая теплота не является функцией состояния и
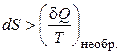 . (2.3)
. (2.3)
Итак, второй закон термодинамики гласит: в изолированной системе самопроизвольно протекает только такие процессы, которые ведут к увеличению неупорядоченности системы, т.е. к росту энтропии. Основной смысл этого закона состоит в том, что в любой изолированной системе с течением времени происходит постоянное возрастание степени беспорядка, а, значит, и рост энтропии.
Или: существует функция состояния S – энтропия, которая следующим образом связана с теплотой, поступающей в систему, и температурой системы:
1. 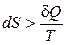 – для самопроизвольных процессов;
– для самопроизвольных процессов;
2. 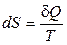 – для обратимых (равновесных) процессов;
– для обратимых (равновесных) процессов;
3. 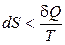 – для несамопроизвольных процессов,
– для несамопроизвольных процессов,
т. е. второй закон термодинамики для различных процессов можно записать с помощью трёх вышеуказанных уравнений.
В изолированной системе (δQ = 0) и изменение энтропии служит критерием направления процесса, т. е. является критерием обратимости и необратимости процессов: если в процессе dS > 0, то он самопроизволен, необратим, а если dS = 0, то он равновесный, обратимый. Энтропия изолированной системы или увеличивается, или остаётся постоянной, и в состоянии равновесия энтропия максимальна: Su,v = Smax и (∆S)u,v = 0.
Следует отметить, что если процесс протекает в неизолированной системе, то для оценки необратимости процесса необходимо иметь величину изменения энтропии системы и величину изменения энтропии окружающей среды.
РАСЧЁТ ИЗМЕНЕНИЯ ЭНТРОПИИ ДЛЯ РАЗЛИЧНЫХ ПРОЦЕССОВ. ПОСТУЛАТ ПЛАНКА.
Дата добавления: 2016-06-18; просмотров: 2363;











