Расчёт энтропии для равновесных (обратимых) процессов.
Второй закон термодинамики в виде 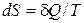 , записанный для равновесных процессов, позволяет вычислить не абсолютное значение энтропии, а только разность энтропий в двух состояниях системы.
, записанный для равновесных процессов, позволяет вычислить не абсолютное значение энтропии, а только разность энтропий в двух состояниях системы.
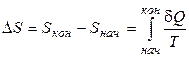 . (2.4)
. (2.4)
Рассмотрим для 1 моля вещества:
а) Изотермические процессы (T = const).
При постоянной температуре протекают процессы фазовых превращений веществ: плавление, испарение и другие. При равновесном протекании этих процессов давление сохраняется обычно постоянным, поэтому 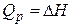 и
и
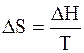 , (2.5)
, (2.5)
где 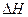 – энтальпия фазового перехода.
– энтальпия фазового перехода.
б) Изобарные процессы (р = const).
Если нагревание происходит при постоянном давлении, то
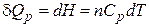 , (2.6)
, (2.6)
где n – число молей вещества. Тогда
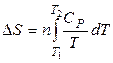 . (2.7)
. (2.7)
Пример 2.1.Определить изменение энтропии при нагреве 1 моль Al от 25 до 6000С, если для него в этом интервале теплоёмкость зависит от температуры следующим образом:

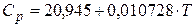 , (Дж/моль К).
, (Дж/моль К).
Решение. Согласно уравнению (2.7) имеем:
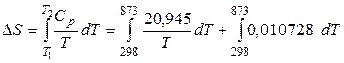 ,
,
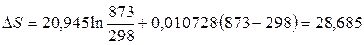 (Дж/моль К).
(Дж/моль К).
с) Изохорные процессы (V = const).
Если нагревание происходит при постоянном объёме, то
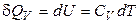 . (2.8)
. (2.8)
Тогда
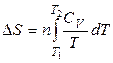 . (2.9)
. (2.9)
Для 1 моля идеального газа справедливо:
а) При изменении объёма и температуры
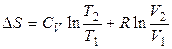 , (2.10)
, (2.10)
с учетом, что 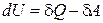 .
.
б) При изменении давления и температуры
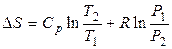 . (2.11)
. (2.11)
Для любого вещества при любой температуре можно определить и абсолютное значение энтропии, если воспользоваться постулатом Планка: энтропия правильно образованного кристалла любого индивидуального вещества при абсолютном нуле равна нулю.
Если вещество при температуре Т находится в газообразном состоянии, то его абсолютная энтропия может быть вычислена по формуле:
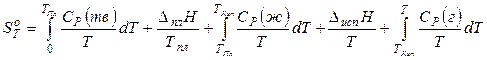 . (2.12)
. (2.12)
Дата добавления: 2016-06-18; просмотров: 2305;











