РАБОТА РАССШИРЕНИЯ ПРИ РАЗЛИЧНЫХ ПРОЦЕССАХ. ЭНТАЛЬПИЯ.
Рассмотрим работу рассширения, совершаемую одним молем идеального газа, в различных условиях:
1). Изотермический процесс (T = const). Поскольку внутренняя энергия идеального газа зависит только от температуры и не зависит от объёма (закон Джоуля), то
U = const Þ dU = 0, (1.7)
тогда
dQ – dA = 0 Þ dQ = dA = 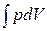 . (1.8)
. (1.8)
Воспользуемся уравнением состояния идеального газа:
pV = RT Þ p = 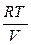 , (1.9)
, (1.9)
тогда
QT = AT = 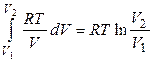 . (1.10)
. (1.10)
Таким образом, работа обратимого изотермического расширения идеального газа совершается только за счет подведенной теплоты.
2). Изохорный процесс (V = const). Следовательно
AV = 0. (1.11)
Тогда
dQV = dU,(1.12)
QV = ∆U. (1.13)
Вся теплота, подведенная к системе, идет на увеличение внутренней энергии. Таким образом, QV является мерой изменения внутренней энергии (в изохорном процессе работа расширения не совершается).
3). Изобарный процесс (p = const). В соответствии с первым законом
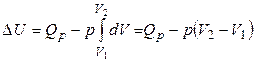 , (1.14)
, (1.14)
или
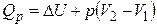 , (1.15)
, (1.15)
т. е. не вся теплота, подведенная к системе, идет на увеличение внутренней энергии. Часть ее расходуется на работу расширения.
Последнее выражение можно записать в следующем виде:
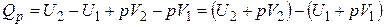 . (1.16)
. (1.16)
Введем новую функцию состояния — энтальпию:
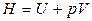 . (1.17)
. (1.17)
Следовательно,
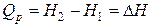 , (1.18)
, (1.18)
т. е. теплота изобарного процесса равна изменению энтальпии.
Изменение энтальпии как функции состояния не зависит от пути протекания процесса, и является полезной величиной при анализе различных термодинамических процессов.
Для химических реакций в газовой фазе справедливо:
QP – QV = ∆(pV) = ∆nRT, (1.19)
т. е.
∆H = ∆U + ∆nRT, (1.20)
где ∆n — изменение числа моль газообразных веществ в ходе реакции.
Итак, ∆U соответствует тепловому эффекту изохорного процесса, а ∆H – изобарного.
ЗАКОН ГЕССА.
В 1836 году русским академиком Г. И. Гессом установленно опытным путём, что тепловой эффект химической реакции не зависит от пути её протекания, а определяется лишь начальным и конечным состоянием системы при p = const или V = const.
Закон Гесса дает возможность рассчитать тепловые эффекты процессов в тех случаях, когда их трудно измерить в определённых условиях или когда в этих условиях нельзя осуществить этот процесс.
Тепловой эффект реакции – максимальное количество теплоты, выделяющееся в необратимом процессе при p = const или V = const, если все вещества имеют одинаковую температуру и отсутствуют другие виды работ, кроме работы расширения.
В химической термодинамике стандартным состоянием называется состояние системы, выбираемое как точка отсчета при оценке термодинамических величин. Необходимость выбора стандартного состояния обусловлена тем, что в рамках химической термодинамики не могут быть рассчитаны абсолютные значения энергий Гиббса, энтальпий и других термодинамических функций для данного вещества. Стандартное состояние характеризуется стандартными условиями – температура 25°С (298.15 К) и давление 1 атм. Тепловые эффекты, отнесённые к этим условиям, называются стандартными тепловыми эффектами.
В качестве стандартного состояния для простых веществ принимают устойчивое фазовое и химическое состояние элемента при данной температуре.
Для расчета теплового эффекта химических реакций используют термохимическте уравнения, в которых обязательно указывается агрегатное состояние реагирующих веществ и продуктов реакции; для твеодых веществ указывается их полиморфная модификация: Сграфит, Салмаз. В термохимических уравнения также указывается тепловой эффект реакции или изменение энтальпии химической реакции, рассчитанное для стандартных условий.
Основу всех термохимических расчетов составляет закон Гесса, который можно представить в виде:
QV = ∆U, V = const, (1.21)
QP = ∆H, p = const.(1.22)
Следствия из закона Гесса:
Следствие 1. Тепловой эффект реакции равен разности сумм теплот образования продуктов реакции и сумм теплот образования исходних веществ при стандартных условиях, умноженных на соответствующие стехиометрические коэффициенты.
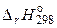 =
= 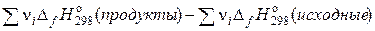 , (1.23)
, (1.23)
знак «o» означает стандартные условия, f – “formation” (образование).
Стандартная теплота образования вещества – это теплота реакции образования вещества из простых веществ, устойчивых при данных условиях.
Следствие 2. Тепловой эффект реакции при стандартных условиях равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции, умноженных на соответствующие стехиометрические коэффициенты.
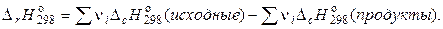 (1.24)
(1.24)
Стандартная теплота сгорания – теплота, выделяющаяся при сгорании в атмосфере кислорода 1 моля вещества при стандартных условиях до высших оксидов.Причём, все участники реакции должны быть в устойчивых агрегатных состояниях.
В химической термодинамике чаще всего рассматриваются изобарные процессы (p = const), для которых QP = ∆H. Поэтому термин «тепловой эффект реакции» заменяют термином «энтальпия реакции». Энтальпия реакции – это изменение энтальпии системы при протекании химической реакции. Она может быть больше нуля или меньше нуля.
Если ∆H > 0, то Q > 0 (эндотермические реакции).
Если ∆H < 0, то Q < 0 (экзотермические реакции).
Дата добавления: 2016-06-18; просмотров: 2710;











