Термодинамическая система, внешняя среда, рабочее тело.
Термодинамической системойназывают совокупность материальных тел, взаимодействующих как между собой, так и с окружающей средой: все другие материальные тела, находящиеся за пределами границ рассматриваемой термодинамической системы, принято называть внешней средой.
Термодинамическая система может быть закрытой (замкнутой), например, газ, находящийся под поршнем в цилиндре двигателя, или открытой,например, поток газа, проходящий через газотурбинный двигатель.
Рабочим теломназывают вещество, содержащееся в термодинамической системе и взаимодействующее с внешней средой в термодинамических процессах.
Рабочим телом авиационных двигателей (газотурбинных или поршневых) являетсяатмосферный воздух, который представляет собой смесь различных газов. Воздух легко сжимается и требует при этом значительно меньших затрат энергии, а также легко расширяется.
1.2. Параметры состояния рабочего тела.
Параметрами состояния рабочего тела называют свойства вещества. Свойства вещества могут быть интенсивными и экстенсивными. Интенсивными называют свойства, не зависящие от количества вещества в термодинамической системе (давление, температура и др.).
Свойства, зависящие от количества вещества, называют экстенсивными, например объём вещества, масса и др. Экстенсивные свойства, отнесенные к массе вещества, приобретают смысл интенсивных свойств, например, удельный объём, плотность вещества – величина, обратная удельному объёму.
Интенсивные свойства, определяющие состояние рабочего тела, называют термодинамическими параметрами состояния рабочего тела:
а) давление– отношение распределенной нагрузки (силы) на единицу поверхности по нормали к ней. Различают абсолютное давление р и избыточное давление ризб (измеряется манометрами или другими регистрирующими приборами).
Абсолютное давление больше избыточного давления на величину атмосферного (барометрического) давления Во, то есть 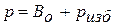 .
.
Если абсолютное давление рабочего тела меньше атмосферного, то регистрирующие приборы (вакуумметры) измеряют разрежение рвак – разность между барометрическим давлением и давлением внутри рабочего тела.
В теплотехнике всегда используется абсолютное давление. Оно измеряется в 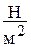 или в Паскалях (
или в Паскалях ( 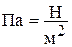 ), а также
), а также 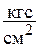 , мм ртутного столба, мм водяного столба (таблица 1.1).
, мм ртутного столба, мм водяного столба (таблица 1.1).
Таблица 1.1
| Наимено-вание единиц | Ньютон на квадрат- ный метр Н/м2, Па | Бар | Кило- грамм сила на квадрат ный метр кгс/м2 | Физи- ческая атмо- сфера атм | Милли- метр водяно- го столба мм вод.ст. | Милли- метр ртут- ного столба мм рт.ст. |
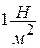
| 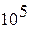
| 1.101972 | 0.98692х
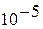
| 0.101972 | 750х
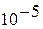
| |
| 1 бар | 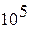
| 10197.2 | 0.98692 | 10197.2 | ||
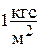
| 9.80665 | 9.80665х
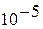
| 0.96784х
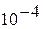
| 735.55х
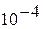
| ||
| 1 атм | 1.01325х
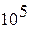
| 1.01325 | 1.3323х
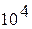
| 1.3323х
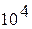
| ||
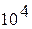 мм
вод.ст мм
вод.ст
| 0.980665х
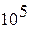
| 0.980665 | 0.96784 | 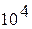
| 735.55 | |
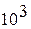 мм
рт.ст. мм
рт.ст.
| 1.33322х
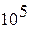
| 1.33322 | 1.35951х
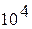
| 1.31579х
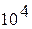
| 1.35951 | 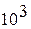
|
1 фунт/дюйм2=6.89х103 Па
Для открытой термодинамической системы, например, для потока газа различают:
- статическое давлениер или давление, действующее на измерительную стенку, поставленную параллельно вектору скорости. Статическое давление измеряется датчиком, установленным в потоке газа и называемым приёмником статического давления (рис.1.1);
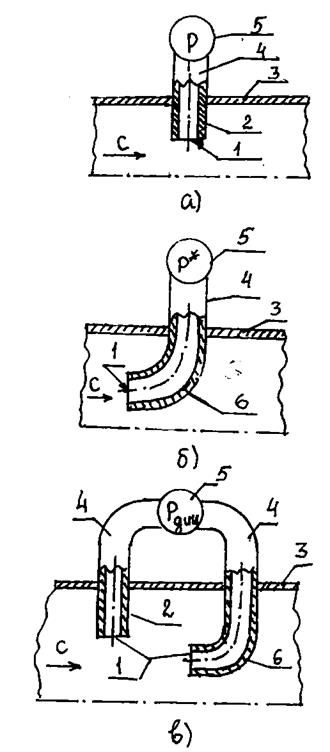
|
Рис.1.1. Схемы измерения статического (а), полного (б) и динамического (в)
давлений в потоке газа:
1 - измерительная стенка; 2 – приёмник статического давления;
3 – корпус канала (трубы); 4 – трубопровод; 5 – регистрирующий прибор;
6 – трубка Пито – Прандтля; с – обозначение вектора скорости газа
- полное давление или давление заторможенного потока 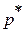 ,или давление, действующее на измерительную стенку, поставленную перпендикулярно вектору скорости. Полное давление измеряется Г – образной трубкой, называемой трубкой Пито – Прандтля(рис.1.1);
,или давление, действующее на измерительную стенку, поставленную перпендикулярно вектору скорости. Полное давление измеряется Г – образной трубкой, называемой трубкой Пито – Прандтля(рис.1.1);
- динамическое давление или скоростной напор 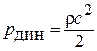 ,или разность между полным и статическим давлениями. На воздушных судах динамическое давление измеряется приёмником воздушного давления(рис.1.1).
,или разность между полным и статическим давлениями. На воздушных судах динамическое давление измеряется приёмником воздушного давления(рис.1.1).
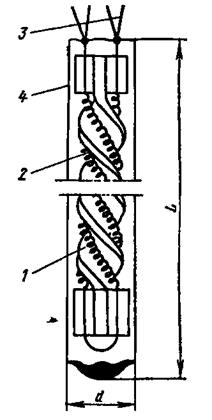
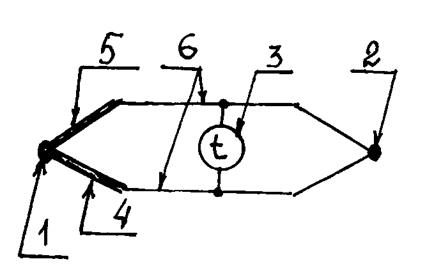
б) температура – степень нагретости тела. Температуру рабочего тела измеряют различными датчиками, принцип действия которых основан на расширении жидкостей или газов при нагревании (ртутный термометр), изменении электрического сопротивления металлов (в термометрах сопротивления(рис.1.2)при измерении температур жидкостей и газов в диапазоне – 50…+700оС ) или на возникновении электродвижущей силы (э.д.с.) (в термопарахпри измерении температур более 300оС ) (рис.1.3).
В авиационной технике приняты:
температурная шкала Андерса Цельсия (1701 – 1744),шведского астронома и физика, предложившего эту шкалу в 1742 году, в которой один градус (1оС) равен 1/100 разности температур кипения воды и таяния льда при нормальном атмосферном давлении (760 мм рт.ст. = 101325 Па), точка таяния льда принята за 0оС, кипения воды – 100оС);
температурная шкала Уильяма Томсона (в 1892 годуза научные заслугиполучилтитул барона Кельвина) (1824 – 1907),английского физика, предложившего эту шкалу в 1848 году, в которой начало шкалы 0оК соответствует полному прекращению движения молекул в рабочем теле;
температурная шкала Габриеля Даниэля Фаренгейта (1686 – 1736), немецкого физика, предложившего эту шкалу в 1724 году, в которой один градус (1оF) равен 1/180 разности температур кипения воды и таяния льда при нормальном атмосферном давлении , точка таяния льда принята равной +32оF.
Все температурные шкалы связаны соотношениями:
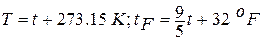 (1.1)
(1.1)
Эффект термоэ.д.с. впервые был открыт в 1821 году Томасом Иоганном Зеебеком (1776 – 1831), немецким физиком, и состоит в появлении электрического тока в цепи, составленной из двух однородных выполненных из разных металлов термоэлектродов, рабочие концы которых сварены между собой и образуют «горячий спай», а свободные концы также сварены между собой и образуют «холодный спай», и помещённых в среды с
|
Рис.1.2. Схема устройства платинового термометра сопротивления
П.Г. Стрелкова:
1 – каркас геликоидальной формы из плавленого кварца; 2 – платиновая
бифилярная спираль диаметром 0.05…0.1 мм; 3 – выводы диаметром
0.3 мм, изготовленные из меди (до 150оС), серебра (до 400оС), золота
(до 700оС) для подключения регистрирующего прибора и источника
питания электрического тока; 4 – оболочка (гильза) диаметром 5…6 мм
и длиной 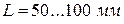 , герметичная и заполненная воздухом, азотом
, герметичная и заполненная воздухом, азотом
или гелием в зависимости от назначения и области измеряемых
температур
|
Рис.1.3. Схема термоэлектрического термометра (термопары):
1 – «горячий» спай при температуре измеряемой среды 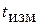 ;
;
2 – «холодный» спай при температуре 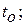 3 – измерительный
3 – измерительный
прибор (гальванометр для измерения э.д.с.); 4 – первый
термоэлектрод (диаметр 1.0…1.5 мм); 5 – второй термоэлектрод
(диаметр 0.8…1.2); 6 – компенсационные провода с малым удельным
электрическим сопротивлением (алюминий, медь и др.)
разными температурами (горячий спай при температуре 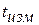 , а холодный спай при
, а холодный спай при 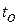 - температуре окружающей среды).
- температуре окружающей среды).
В авиационной технике большое распространение получили термопары типа ХА [хромель (сплав на никелевой основе (89 % Ni + 9.8 % Cr + 10 % Fe +0.2 % Mn) + алюмель ( сплав на никелевой основе (94 % Ni + 2 % Al + 2.5 % Mn + 1 % Si + 0.5 % примеси)] для измерения температур при длительном применении в диапазоне – 200…1000оС, и термопары типа ХК [хромель + копель (сплав содержит 56 % Cu и 44 % Al)] для измерения температур в диапазоне – 200…600оС. Электрический ток в термопаре идет от термоэлектрода с большим удельным электрическим сопротивлением (положительный термоэлектрод) к термоэлектроду с меньшим электрическим сопротивлением (отрицательный термоэлектрод). Например, в термопарах типа ХА хромель имеет удельное электрическое сопротивление 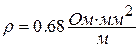 , алюмель -
, алюмель - 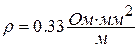 , а в термопарах типа ХК копель
, а в термопарах типа ХК копель 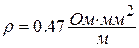 .
.
в) удельный объём v – отношение массы рабочего тела к его объему, размерность 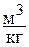 или
или 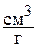 . Обратная величина, как уже отмечалось, представляет собой плотность рабочего тела, то есть r=1/v, размерность
. Обратная величина, как уже отмечалось, представляет собой плотность рабочего тела, то есть r=1/v, размерность 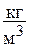 или
или 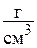 .
.
1.3. Основные законы для идеального газа.
Идеальным газом называется газ, молекулы которого имеют массу, бесконечно малые размеры и не взаимодействуют друг с другом (кроме соударения).
Свойства идеальных газов, как известно из физики, основаны на экспериментальных законах:
1. Закон Роберта Бойля (1627 – 1691),английского химика и физика, установившего этот закон в 1662 году, и Эдма Мариотта (1620 – 1684),
французского физика, установившего этот закон в 1676 году: произведение объёма данной массы идеального газа на его давление постоянно при постояннойтемпературеили 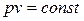 .
.
2. Закон Жозефа Луи Гей-Люссака (1778 – 1850),французского химика и физика, установившего впервые этот закон в 1802 году: объём данной массы идеального газа при постоянном давлении линейно возрастает с ростомтемпературы,то есть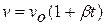 ,где
,где 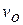 - удельный объём при
- удельный объём при 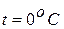 ; β – коэффициент объёмного расширения равный
; β – коэффициент объёмного расширения равный 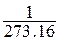 на 1оС.
на 1оС.
3. Закон Жана Шарля (1746 – 1823),французского ученого, установившего этот закон впервые в 1787 году, и уточненный Ж.Гей-Люссакомв 1802 году: давление идеального газа неизменной массы и объёма возрастает при нагревании линейно,то есть 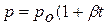 ), где ро – давление при
), где ро – давление при 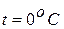 .
.
4. Закон Клапейрона Бенуа Поля Эмиля (1799 – 1864), французского физика и инженера, установившего этот закон впервые в 1834 году, и дополненный Дмитрием Ивановичем Менделеевым (1834 – 1907),российским химиком, для одного моля идеального газа в 1874 году (уравнение состояния для идеального газа):
а) для массы газа 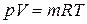 ; б) для 1 кг массы газа
; б) для 1 кг массы газа 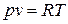 ,
,
где 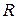 - газовая постоянная или количество работы, совершаемой 1 кг газа в процессе при постоянном давлении при изменении температуры на один градус Кельвина. Газовая постоянная определяется по формуле:
- газовая постоянная или количество работы, совершаемой 1 кг газа в процессе при постоянном давлении при изменении температуры на один градус Кельвина. Газовая постоянная определяется по формуле:
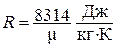 , где
, где 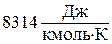 - универсальная газовая постоянная;
- универсальная газовая постоянная; 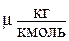 - масса одного киломоля газа.
- масса одного киломоля газа.
Для вычисления универсальной газовой постоянной используются два соотношения:
а) на основании молекулярно-кинетической теории
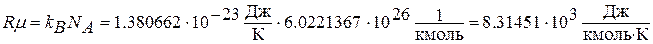
где 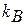 - постоянная Людвига Больцмана (1844 – 1906), австрийского физика;
- постоянная Людвига Больцмана (1844 – 1906), австрийского физика; 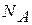 - число Амедео Авогадро (1776 – 1856), итальянского физика и химика (число молекул или атомов в 1 киломоле вещества);
- число Амедео Авогадро (1776 – 1856), итальянского физика и химика (число молекул или атомов в 1 киломоле вещества);
б) из уравнения состояния идеального газа
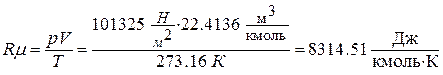 ,
,
где 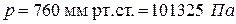 - нормальное давление;
- нормальное давление; 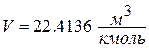 - объём, занимаемый газом при нормальном давлении (установлено А.Авогадро в 1811 году).
- объём, занимаемый газом при нормальном давлении (установлено А.Авогадро в 1811 году).
1.4. Основные газовые законы для смеси идеальных газов.
Что касается определения газовой постоянной для смеси газов, например, для атмосферного воздуха, то здесь используются следующие законы для идеального газа:
1.Закон Джона Дальтона (1766 – 1844),английского химика и физика, впервые установившего этот закон в 1801 году: давление смеси газов, химически не взаимодействующих друг с другом, равно сумме их парциальных давлений:
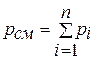 (1.2)
(1.2)
2. Закон Амага (1841 – 1915): сумма парциальных объёмов составляющих газов равна объёму смеси газов:
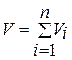 (1.3)
(1.3)
Состав смеси газов задают обычно объёмными (молярными) или массовыми долями:
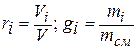
Молярной долей называют также отношение числа киломолей компонента к числу киломолей смеси
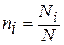
Пересчёт объёмных долей в массовые и обратно производится на основе следующих соотношений, справедливых как для смеси в целом, так и для каждого компонента (на основании названных выше законов Дальтона, Амага и Клапейрона – Менделеева для идеальных газов):
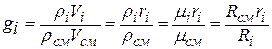 , где rсм – плотность смеси,
, где rсм – плотность смеси, 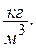
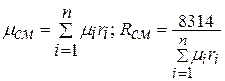 ;
;
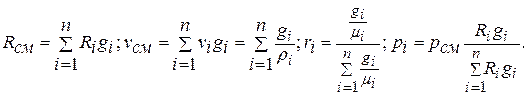 (1.4)
(1.4)
В таблице 1.2 приведен состав сухого воздуха. На основании данных этой таблицы можно определить газовую постоянную сухого воздуха:
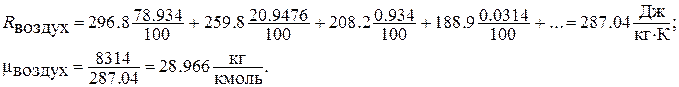
Таблица 1.2
Дата добавления: 2020-02-05; просмотров: 1483;











