Деформационная работа всегда связана с перемещением макроскопических тел в пространстве, например, с перемещением поршня, деформацией оболочки,
поэтому она характеризует упорядоченную (макрофизическую) форму передачи энергии от одного тела к другому и является мерой переданной энергии.
Поскольку величина 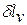 пропорциональна увеличению объема, то в качестве рабочих тел, предназначенных для преобразования тепловой энергии в механическую работу, целесообразно выбирать такие вещества, которые обладают способностью значительно увеличивать свой объем. Этим качеством обладают газы и пары жидкостей. Поэтому, например, на тепловых электрических станциях рабочим телом служат пары воды, а в двигателях внутреннего сгорания — газообразные продукты сгорания того или иного топлива.
пропорциональна увеличению объема, то в качестве рабочих тел, предназначенных для преобразования тепловой энергии в механическую работу, целесообразно выбирать такие вещества, которые обладают способностью значительно увеличивать свой объем. Этим качеством обладают газы и пары жидкостей. Поэтому, например, на тепловых электрических станциях рабочим телом служат пары воды, а в двигателях внутреннего сгорания — газообразные продукты сгорания того или иного топлива.
Аналогичные рассуждения можно привести и при анализе технической работы(рис.1.5). Здесь 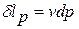 - элементарная техническая работа, связанная с изменением давления на границах «рабочее тело – внешняя среда», характерная для открытой термодинамической системы.
- элементарная техническая работа, связанная с изменением давления на границах «рабочее тело – внешняя среда», характерная для открытой термодинамической системы.
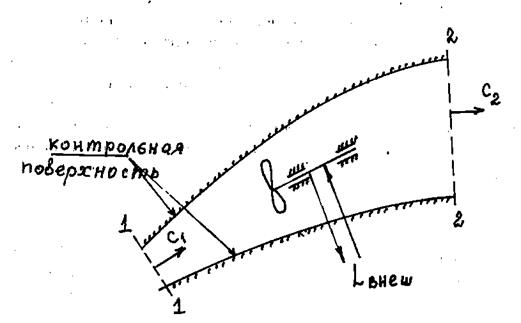
На рис.1.6 показан криволинейный канал, по которому движется газовый поток. Внутри канала размещается лопаточный аппарат, к которому может подводиться (например, для вращения вентилятора, компрессора, насоса и т.п.) или отводиться (например, при вращении турбины, тахометра и т.п.) внешняя механическая работа  .
.
|
Рис.1.6. Пример открытой термодинамической системы – поток газа
в криволинейном канале:
1 – 1 – поперечное (контрольное) сечение газового потока на входе
в канал; 2 – 2 – то же на выходе из канала
В результате подвода этой энергии в рабочем теле либо возрастает давление (например, при сжатии газа), либо давление уменьшается (например, при расширении газа). То есть к рабочему телу может либо подводиться техническая работа 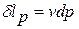 при
при 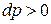 , либо отводиться при
, либо отводиться при 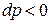 . Для лопаточных аппаратов в данном случае техническая работа эквивалентна работе на окружности колеса турбомашины.
. Для лопаточных аппаратов в данном случае техническая работа эквивалентна работе на окружности колеса турбомашины.
Интеграл 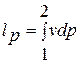 в данном случае называют интегралом Д. Бернулли.
в данном случае называют интегралом Д. Бернулли.
Поскольку при вычислении технической работы неизвестно изменение удельного объёма от давления 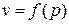 , величина
, величина 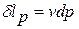 не является полным дифференциалом. В
не является полным дифференциалом. В  диаграмме эта работа представляет собой площадь под кривой процесса «12» относительно оси давлений и крайними абсциссами.
диаграмме эта работа представляет собой площадь под кривой процесса «12» относительно оси давлений и крайними абсциссами.
1.6. Уравнение состояния для реального газа.
Для реального газа уравнение состояния впервые было разработано в 1873 году Йоханнесом Дидериком Ван-Дер-Ваальсом (1837 – 1923),нидерландским физиком (лауреатом Нобелевской премии в 1910 году):
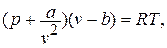 (1.5)
(1.5)
где коэффициент «а» учитывает силы молекулярного притяжения каких либо частей газа; коэффициент «b» учитывает наименьший объём, до которого можно сжать газ.
Написанное уравнение оказывается 3 – ей степени относительно удельного объёма:
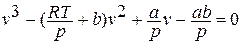
При различных значениях температуры Т приводит к следующим результатам.
1. В 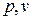 диаграмме при высоких температурах изотермический процесс
диаграмме при высоких температурах изотермический процесс
реального газа ( 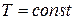 ) близок к изотермическому процессу идеального газа (линии «1 – 1’» на рис.1.7). При этих условиях каждому значению давления отвечает определенная величина удельного объёма, то есть из трех корней уравнения только один корень действительный, а два других мнимые, иначе лишены физического смысла. Если температуру ещё более повысить, то новая изотерма «0 – 0’» на рис.1.7 практически будет равнобокой гиперболой, как в случае идеального газа. Физически
) близок к изотермическому процессу идеального газа (линии «1 – 1’» на рис.1.7). При этих условиях каждому значению давления отвечает определенная величина удельного объёма, то есть из трех корней уравнения только один корень действительный, а два других мнимые, иначе лишены физического смысла. Если температуру ещё более повысить, то новая изотерма «0 – 0’» на рис.1.7 практически будет равнобокой гиперболой, как в случае идеального газа. Физически 


 это связано с тем, что
это связано с тем, что
при больших температурах влияние числа 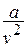 , а затем и объёма молекул «
, а затем и объёма молекул « 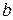 » пренебрежимо мало.
» пренебрежимо мало.
2. Изотермы при низких температурах имеют вид, соответствующий кривой, например, «2—2'». Эта кривая пересекает линию 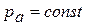 в трех точках: a, b, c; следовательно, при низких температурах для каждого значения давления
в трех точках: a, b, c; следовательно, при низких температурах для каждого значения давления 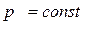
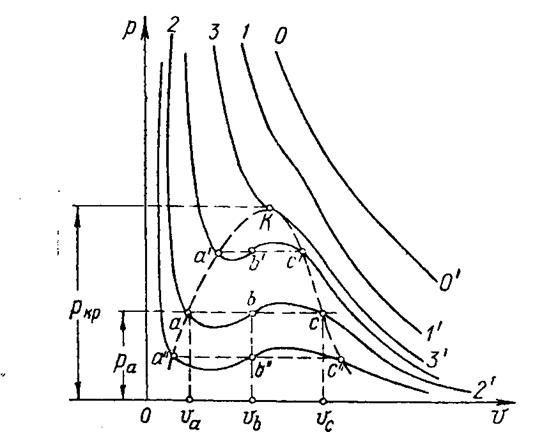
Рис.1.7. Изображение уравнения состояния реального газа в 
диаграмме
уравнение состояния Ван-Дер-Ваальса даёт три действительных корня:  .
.
На графике рис.1.7 нанесены три такие изотермы. Для изотермы «2—2'» участок кривой «2 – а» соответствует жидкой фазе вещества; точка «а» начало кипения. Точка «с» соответствует полному испарению жидкости, при этом пар находится при температуре кипения, соответствующей давлению: в точке «b» - двухфазная среда (жидкость и пар). Следовательно, волнообразный участок a – b – c изотермы «2—2'» по уравнению Ван-Дер-Ваальса соответствует процессу испарения жидкости, что противоречит опыту: на этом остановимся несколько ниже. Чем выше температура в этой области, тем короче участок волнообразной кривой.
3. Наконец, для каждого вещества есть своя единственная изотерма
«3 – 3’», кривая которой в некоторой точке «к» имеет перегиб. Для этой изотермы все три корня уравнения Ван-Дер-Ваальса получают действительные и равные значения. Верхний участок «3 – к» кривой «3 – 3’» соответствует границе двухфазного (жидкого и газообразного) состояния вещества; нижний участок k—3' соответствует парообразному и в правой части при низких давлениях газообразному состоянию. Таким образом, по изотерме «3 – 3’» нет такого процесса испарения, который был, например, по изотерме «2—2'». Вещество в точке «к» может находиться и в жидком, и в газообразном состояниях. Ничтожно малое увеличение температуры (или давления при  ) сразу переводит жидкость в пар; наоборот, незначительное уменьшение температуры переводит пар в жидкость. Точка «к» называется критической, а температура, давление и удельный объем в этом состоянии называются соответственно критической температурой
) сразу переводит жидкость в пар; наоборот, незначительное уменьшение температуры переводит пар в жидкость. Точка «к» называется критической, а температура, давление и удельный объем в этом состоянии называются соответственно критической температурой 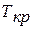 , критическим давлением
, критическим давлением 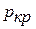 и критическим удельным объемом
и критическим удельным объемом 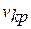 .
.
Если давление 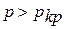 , температура
, температура 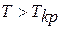 , то невозможен переход пара в жидкость; вещество может находиться только в однофазном состоянии (пар, газ).
, то невозможен переход пара в жидкость; вещество может находиться только в однофазном состоянии (пар, газ).
В таблице 1.3 приводятся значения критических параметров состояния некоторых веществ.
Таблица 1.3
Температуры и теплоты фазовых переходов;
Дата добавления: 2020-02-05; просмотров: 995;











