Степень связности кремнекислородного каркаса и активность кислорода
У чистого кварцевого стекла каждая из кислородных вершин является общей для двух тетраэдров. Каждый атом кислорода соединяет два тетраэдра. При введении в кварцевое стекло первых порций оксида Ме2О или МеО по соседству с некоторыми ионами кислорода оказываются катионы Ме+ или Ме2+, обладающие более слабым силовым полем по сравнению с катионом кремния (табл. 2.2). Поэтому у части тетраэдров одна из вершин ослабляется.
Таблица 2.2
Единичные энергии связи катионов с кислородом
| Звено структуры | Si-O | Na-O | K-O | Ca-O | Mg-O |
| Единичная сила связи, кДж/моль |
Скелет стекла, содержащего 67 мол.% SiO2 в среднем состоит из тетраэдров с одной ослабленной вершиной. Это составы Me2O∙2SiO2 и MeO∙2SiO2:
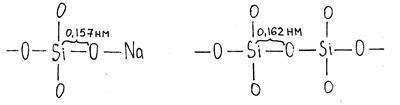
По данным рентгенографического анализа при введении катионов-модификаторов кремнекислородные тетраэдры деформируются. В структурном фрагменте Si–О…Na расстояние Si–O сокращается до 0,157 нм.
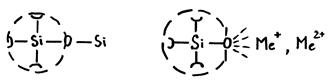
Возникает поляризация аниона кислорода под воздействием центрального катиона (контрполяризация). Ее также называют вторичной поляризацией.
Введение в стекло оксидов Ме2О или МеО приводит к искажению тетраэдров SiO4 в сторону их уплотнения. Поэтому парциально-мольный объём диоксида кремния уменьшается.
Из-за ослабления одной из вершин возрастает способность к колебательным движениям тетраэдра SiO4. Парциальный коэффициент термического расширения SiO2 в сложных стеклах в несколько раз больше по сравнению с чистым стеклообразным кремнезёмом.
При добавлении оксидов МеО и Ме2О сверх 33 мол.% «ослабляется» вторая вершина тетраэдров, потом третья и четвёртая. Далеко не всегда идёт последовательное ослабление тетраэдров SiO4. В ряде случаев могут сразу строиться тетраэдры с двумя ослабленными вершинами (что соответствует метасиликатам), таких тетраэдров будет в два раза меньше. Например, в стекле, содержащем 67 мол.% SiO2, при ослаблении двух вершин кремнекислородных тетраэдров, половина тетраэдров оказываются деформированными, другая половина – сохраняет структуру кварцевого стекла.
Изменение связности кремнекислородного каркаса особенно резко сказывается на вязкости стекла. Например, в системе Na2O - SiO2 вязкость уменьшается на 8 порядков величины при уменьшении структурного коэффициента fSi от 0,5 до 0,4:
Т = 1400˚С: вязкость SiO2 составляет 1010,6пуаз,
вязкость Na2O∙2SiO2 равна 2,8∙102 пуаз.
Флюсующее действие модификаторов обусловлено разрывом мостиков Si-O-Si:
≡Si−O−Si≡ + Na2O → 2(≡Si−O- Na+).
Подобным же образом действует и вода:
≡Si−O−Si≡ + Н2O → 2(≡Si−OН).
В присутствии щёлочи образуется водородная связь: Na+
2(≡Si−O−Si≡) + Na2O +Н2О → 2(≡Si−OН…О-−Si≡).
Действие фторидов сводится к реакции:
≡Si−O−Si≡ + NaF → (≡Si−O- Na+F-−Si≡).
Анионы F- и OH- известны, как энергичные минерализаторы. Они способствуют росту кристаллических частиц в расплавах.
Составы всех обычных силикатных стекол укладываются в норму:
fSi > 0,333 или y > 2.
Содержание SiO2 в них превышает 50 мол.% и образуются протяжённые вязаные структуры из тетраэдров SiO4. Инвертные стекла построены из отдельных изолированных друг от друга кремнекислородных тетраэдров и кремнекислородных групп. Поэтому к ним неприменимы общие законы изменения свойств обыкновенных стёкол. В инвертных стёклах направление изменения вязкости, как функции от молярного содержания оксидов МеО, становится обратным. Катионы Ме2+ объединяют отдельные тетраэдры или их группы. Свойства инвертных стёкол определяются содержанием металлических ионов. В инвертных стёклах проявляются преимущественно полупроводниковые свойства.
От степени связности кремнекислородного каркаса зависит состояние структурного кислорода в силикатном стекле и его активность. В стекле могут существовать мостиковые (Оо) и немостиковые (О-) атомы кислорода, связанные с кремнием ковалентными связями. Свободные ионы кислорода (О2-) могут возникать при диссоциации силикатов. Соотношение между различными состояниями атомов кислорода регулируется протеканием химической реакции:
МеО∙mSiO2 ↔ m SiO2 + МеО ↔ m SiO2 + Ме2+ + O2-.
Это превращение описывается следующей простой схемой:
2(≡Si−O-) ↔ ≡Si−O−Si≡ + O2-
или 2О- ↔ Оо + О2-.
Закон действующих масс:
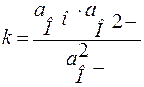 ;
; 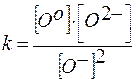 .
.
Т = 1600˚С FeO - SiO2 k=0,17
CaO - SiO2 k=0,0017
Повышенной концентрацией свободных ионов кислорода О2- объясняется высокая электропроводность фаялита (FeO∙SiO2).
Соотношение различных форм кислорода зависит от содержания диоксида кремния (рис. 2.12).
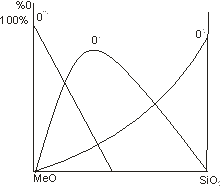
Рис. 2.12. Относительное содержание различных форм кислорода
в двойной системе MeO-SiO2
Немостиковый кислород О- является промежуточной формой, связанной с разрывом кремнекислородной сетки оксидами модификаторами.
Дата добавления: 2018-11-26; просмотров: 922;











