Мостиковые и немостиковые атомы кислорода.
В структуре кварцевого стекла все атомы кислорода мостиковые (рис. 2.9). Группировка SiO44- имеет отрицательный заряд -4, но каркасная сетка из тетраэдров SiO4 в целом электронейтральна, так как каждый атом кислорода связан с двумя атомами кремния.
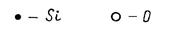
Рис. 2.9. Структура кварцевого стекла
Протяжённость кремнекислородной сетки в силикатных стеклах зависит от содержания диоксида кремния. Стеклообразователи – это компоненты стекла, способные самостоятельно образовывать непрерывную структурную сетку – SiO2, В2О3, Р2О5 и другие. Эту непрерывную бесконечную сетку разрывают оксиды модификаторы. Катионы модификаторов располагаются в свободных межтетраэдрических полостях, замыкая на себя заряд анионов кислорода. Прочность связи модификатора с кислородом много ниже прочности связи кислорода с кремнием.
Мостиковые атомы кислорода соединяют соседние полиэдры. При введении модификаторов появляются немостиковые атомы кислорода. Немостиковые атомы кислорода соединяют катионы-модификаторы со сложными анионами. Прочная сетка из ионно-ковалентных связей нарушается вкраплениями слабых ионных связей, в которых катионы-модификаторы перехватывают второй р – электрон кислорода.
В борном ангидриде мостиковые атомы кислорода также создают трёхмерную пространственную сетку (рис. 2.10).
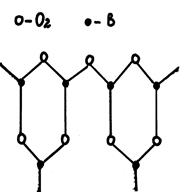
В2О3 кристаллический
Рис. 2.10. Двухмерная модель кристаллического борного
ангидрида
Введение в силикатное стекло оксидов щелочных металлов приводит к разрыву кремнекислородной сетки, что можно считать следствием химического взаимодействия (рис.2.11).
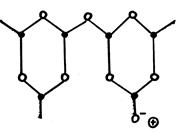 − модификатор
− модификатор
Рис.2.11. Немостиковый атом кислорода в структуре стекла
Ме2О - SiO2; Ме: Li, Na, K, Rb, Cs.
Протекает реакция деполимеризации:
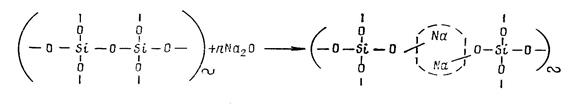
По мере увеличения концентрации оксидов Ме2О растет число разрывов и увеличивается количество немостиковых атомов кислорода. Формальный анализ показывает, что при концентрации Ме2О > 50 мол.% в силикатах возникают изолированные фрагменты из кремнекислородные тетраэдры или даже отдельные тетраэдры. Такие расплавы кристаллизуются чрезвычайно быстро, так как облегчены условия переориентации структурных единиц. Экспериментальные исследования показали, что концентрационные области стеклообразования в конкретных системах определяются природой оксида-модификатора.
Области стеклообразования:
SiO2 – Li2O 100 – 64 мол.% SiO2
SiO2 – Na2O 100 – 48 мол.% SiO2
SiO2 – K2O 100 – 46 мол.% SiO2
При замене оксидов щелочных металлов на оксиды щелочноземельных металлов степень связности структурной сетки возрастает. Двухвалентные катионы, стягивая отдельные кремнекислородные группировки, способны, в определенной степени, стабилизировать свойства стекла. Это катионы Ca2+, Mg2+, Sr2+, Ba2+.
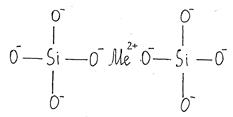
Однако возникающая ионная связь, в отличие от ковалентной, не является направленной. Прочность связи кислорода с двухвалентными катионами меньше, чем с кремнием. Кремнекислородный каркас ослабляется при введении катионов Ме2+, поэтому оксиды МеО также широко используются в качестве модификаторов.
Дата добавления: 2018-11-26; просмотров: 1743;











