Компактность упаковки ионов в структуре
Структуры кристаллических и стеклообразных форм диоксида кремния не являются плотно упакованными. Кремнекислородные тетраэдры в них соединяются вершинами, а не ребрами и не гранями.
Плотность кристобалита и тридимита гораздо меньше плотности кварца, обладающего более компактной структурой (табл. 2.3).
Таблица 2.3
Свойства различных кристаллических модификаций
диоксида кремния
| Модификации SiO2 | Кварц | Кристобалит | Тридимит |
| Структура | Гексагональная | Кубическая | Гексагональная |
| Плотность, г/см3 | 2,65 | 2,32 | 2,26 |
Плотность стеклообразного кремнезёма составляет 2,203 г/см3. Очевидно, в структуре стеклообразного кремнезёма и силикатных стёкол имеются крупные межатомные полости. Весьма вероятно, что силикатные стёкла имеют кристобалитную структуру.
В каждой элементарной ячейке кристобалита, включающей 16 ионов кислорода, имеются 4 межтетраэдрические полости. Следовательно, на каждые 4 атома кислорода приходится одна полость.
Стевелс, основываясь на предпосылке кристобалитной структуры стекла, подразделяет силикатные стёкла на два класса.
Нормальные стёкла: в них соотношение О/Ме > 3,9.
Не все межтетраэдрические полости заняты металлическими ионами, поскольку отношение числа ионов кислорода к числу металлических катионов Ме+ и Ме2+ больше 3,9.
Ненормальные стёкла: О/Ме < 3,9.
Число металлических ионов превышает число пор между тетраэдрами, должна возникать другая структура.
В нормальных стёклах катионы Ме+ и Ме2+ помещаются в полостях без заметного влияния на объём кислородного каркаса. Объем одного грамм атома кислорода в нормальных стёклах зависит только от кислородного числа и не зависит от природы и концентрации металлических ионов.
Для нормальных стёкол выполняется зависимость:
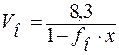 ,
,
Vо – объём грамм-атома кислорода;
fо – кислородное число;
х – постоянная.
Здесь 8,3 – объем (см3), занимаемый одним грамм-атомом кислорода при плотнейшей упаковке. Такая упаковка наблюдается в оксиде берилия ВеО, молярный объём которого Vо = 8,36 см3.
В силикатных стёклах упаковка кислорода далека от плотнейшей. Объём грамм атома кислорода для кварцевого стекла близок к 1/2 VSiO2 = 13,6 см3. Ион Si4+ помещается в тетраэдрической полости. Зависимость объёма грамм-атома кислорода от кислородного числа в нормальных стёклах иллюстрирует рис.2.13.
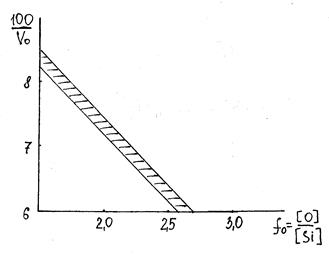
Рис. 2.13. Влияние кислородного числа на объём
грамм-атома кислорода
Для нормальных стёкол, чем выше кислородное число, тем меньше отношение 100/Vо, т.е. тем больше объём одного грамм-атома кислорода.
В силикатных стёклах свободный межтетраэдрический объём уменьшается не за счёт уплотнения упаковки кислородных ионов, а, прежде всего, благодаря заполнению полостей крупными металлическими ионами. Поэтому натриево-силикатные и, в особенности, свинцово-силикатные стёкла гораздо менее проницаемы для газов (Не, Ne, Н2), чем стеклообразный кремнезём (табл. 2.4).
Таблица 2.4
Коэффициенты проницаемости стёкол для гелия.
| Стекло | Температура, оС | ζ∙103, м/с∙Па |
| Кварцевое | 2,37 | |
| Пирекс | 0,29 | |
| Натриево-силикатное | 0,0077 | |
| Свинцово-силикатное | 0,0028 |
Газопроницаемость уменьшается на три порядка величины при переходе от обычных к свинцовым стёклам. Структура силикатных стёкол, исключая боросиликатные, разрыхляется при замене одно- и двухвалентных катионов более крупными. Разрыхление происходит за счет увеличения средних межионных расстояний и сопровождается уменьшением свободного межтетраэдрического объёма. Суммарный свободный объём (межтетраэдрический и внутритетраэдрический) вычисляется по уравнению:
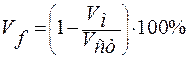 ,
,
где Vм – объём стекла, вычисленный из размеров ионов;
Vст – молярный объём стекла, вычисленный из плотности.
Из сопоставления плотности кварцевого стекла и α-кварца нашли, что свободный объём в кварцевом стекле составляет не менее 13% объёма. Однако, оценка по физической растворимости газов приводит к Vf = 3об.%. Видимо, лишь часть свободного объёма способна поглощать и пропускать газ.
Размер межтетраэдрических пор в силикатном стекле различен. Когда пустоты в структуре стекла заняты одним щелочным ионом, то упаковка не будет энергетически выгодной. Если в стекле присутствуют два вида щелочных ионов различных размеров, то распределение ионов по межтетраэдрическим пустотам оказывается более энергетически выгодным и связи ионов с кремнекислородным скелетом становятся более прочными. Это явление вызывает повышение плотности, механической прочности, возрастает сопротивление химической коррозии, улучшаются и другие свойства стекла. Такое совместное влияние двух различных модификаторов на структуру и свойства стёкол получило название двухщелочного эффекта.
2.2. Координационные эффекты в стёклах
Зависимость свойств соединений от их структуры обусловлено двумя факторами:
1. Характером пространственного расположения кислородных полиэдров и способом их связи между собой;
2. Координационным числом катионов относительно ионов кислорода.
1. Различную ориентацию тетраэдры SiO4 имеют в разных кристаллических модификациях SiO2: кварц, тридимит, кристобалит. Во всех случаях координационное число кремния равно 4, но способы построения геометрически правильной кремнекислородной сетки разные. Плотность кремнезёма меняется в пределах ρ = 2,2 ÷ 2,6 г/см3, различие плотности незначительное (в 1,18 раз).
Первый фактор не играет существенной роли в формировании свойств силикатных стёкол, так как:
а) в стекле энергетически выгоден способ связи тетраэдров через вершины, а не через ребра и грани;
б) углы взаимной ориентации тетраэдров в стеклах весьма разнообразны.
2. Диоксид германия GeO2 может находиться в двух кристаллических состояниях. Свойства двух форм этого соединения различны. В частности, они отличаются по химической устойчивости (табл. 2.5).
Таблица 2.5
Свойства различных форм диоксида германия
| Растворимая форма | Нерастворимая форма |
| Четверная координация | Шестерная координация |
| ρ = 4,22 г/см3 | ρ = 6,24 г/см3 |
Плотность модификаций различается в 1,5 раза, свойства оксида резко изменились при переходе из четверной координации в шестерную.
Для диоксида кремния SiO2 также известны различные координации кремния по отношению к кислороду – четверная и шестерная (табл. 2.6):
Таблица 2.6
Свойства различных форм диоксида кремния
| Тетраэдрическая форма | Октаэдрическая форма |
| Кварц, тридимит, кристобалит | Стишовит – рутилоподобная форма SiO2 |
| к.ч. = 4: вершин – 4, граней – 4 | к.ч. = 6: вершин – 6, граней – 8 |
| ρ = 2,26 - 2,65 г/см3 | ρ = 4,35 г/см3 |
Плотность диоксида кремния резко возросла. Поэтому от координации катионов существенно зависят свойства кислородных соединений.
Дата добавления: 2018-11-26; просмотров: 983;











