Оральная толерантность. Иммунология печени
В то время как формирование активного иммунного ответа на патоген не представляет собой удивительное явление, способность иммунной системы ЖКТ избирательно узнавать и игнорировать непатогенные антигены (например, бактерии, обладающие свойством симбиоза, и пищевые частицы) является более впечатляющим качеством. В основе феномена «оральной толерантности» лежит ряд механизмов (рис. 5.10).
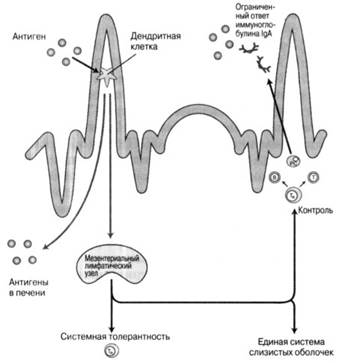
Рис. 5.10. Механизмы оральной толерантности. Антигены из пищи или эндогенной микрофлоры попадают в мембрану и активируют регуляторные Т-лимфоциты, которые предотвращают развитие полного иммунного ответа. Эти регуляторные клетки могут также действовать системно для предотвращения реакций на те же самые антигены, проникшие парентерально. ПК - плазматическая клетка; Т - регуляторная Т-клетка
Впервые оральная толерантность была установлена экспериментально, когда после введения антигена перорально грызунам в лаборатории не удалось получить иммунного ответа на парентеральное введение того же самого антигена. В основном механизм оральной толерантности был описан с помощью подобных моделей у грызунов; однако, этот феномен также наблюдался у собак и кошек.
Оральная толерантность рассматривается в качестве активного иммунологического процесса, а не простого игнорирования этих классов антигенов и неспособности сформировать ответ на них. Предполагается, что такие антигены поступают в мембрану собственной пластинки преимущественно через энтероциты или дендритные клетки мембраны собственной пластинки, которые продолжают цитоплазматические процессы через плотные эпителиальные соединения (в отличие от М-клеток и пейеровых бляшек).
Здесь они (дендритные клетки, энтероциты или и те и другие) активируют популяцию регуляторных Т-клеток, в частности Т-клеток, преимущественно продуцирующих регуляторный цитокин - интерлейкин 10 (IL-10) или Т-хелперы 3 (Th3), которые экспрессируют трансформирующий фактор роста бета (ТФРβ).
Эти регуляторные Т-клетки могут быть посредниками в реакции местной невосприимчивости и, кроме того, могут мигрировать в иммунную систему всего организма для обеспечения системной невосприимчивости, характерной для экспериментальной оральной толерантности.
Способность индуцировать системную иммунную невосприимчивость при поступлении антигенов с пищей (или попаданием антигена через слизистые оболочки другими путями) - область активных современных исследований, имеющих значение для лечения неадекватной иммунной реактивности, подобной той, что наблюдается при аутоиммунных или аллергических заболеваниях.
Непосредственное значение для домашних животных имеют воспалительные заболевания кишечника (ВЗБ). Предполагается, что патогенез целого спектра ВЗК включает нарушение нормальной толерантности к эндогенной бактериальной микрофлоре и пищевую гиперчувствительность с нарушением иммунологической толерантности к обычным пищевым компонентам. Новые методы лечения этих заболеваний основаны на блокировании иммунных путей, описанных выше.
Иммунология печени. У домашних животных было проведено мало исследований, касающихся иммунной системы печени, по сравнению с ЖКТ, поэтому наше понимание основано на экстраполяции знаний, полученных при исследовании других видов. В норме печень содержит большое количество подвижных синусоидальных клеток Купфера, которые обладают фагоцитарной активностью, экспрессируют ГКГ II класса, секретируют цитокины (например, IL-6 и фактор некроза опухоли α (ФНО α), стимулирующих продукцию белков острой фазы) и действуют как АПК.
В портальной триаде также могут быть обнаружены макрофаги и дендритные клетки. Печень содержит немигрирующую популяцию лимфоидных клеток, включая портальные и синусоидальные Т-клетки, и внутриэпителиальные Т-клетки эпителия желчных протоков. Популяция Т-клеток богата CD8+ и γδTCR+ клетками, также присутствуют Т-киллеры (NK). В портальной зоне обнаружено небольшое содержание В-лимфоцитов.
Популяции мезенхимальных клеток пространства Диссе (клетки Ито, звездчатые клетки или ли- поциты печени) продуцируют коллаген, коллагеназу, ингибитор коллагеназы и ряд цитокинов и хемоки- нов, привлекающих и использующих моноциты и лимфоциты. Синусоиды печени выстланы уникальными эндотелиальными клетками печени (ЭКП).
Эти клетки фенестрированы, расположены с разрывами между собой, не имеют базальной мембраны собственной пластинки и способны представлять антиген. Поэтому возможно быстрое передвижение молекул из синусоидальной крови в пространство Диссе (рис. 5.12).
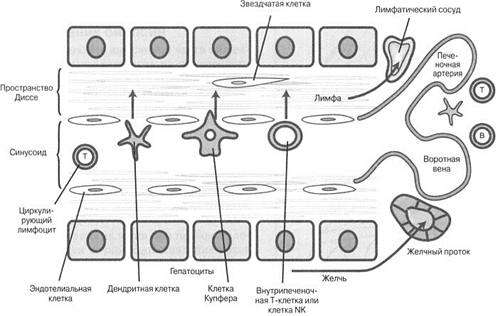
Рис. 5.12. Иммунная система печени. Ряд антиген-представляющих клеток (АПК) и лимфоцитов мигрирует из крови, омывающей синусоидальную клетку, в пространство Диссе. Оседлые иммунные клетки располагаются в портальной зоне печени
Эти клетки постоянно экспрессируют адгезивные молекулы, которые связываются с лигандами циркулирующих лимфоцитов. Циркулирующие лимфоциты и дендритные клетки могут путем хемотаксиса направляться в пространство Диссе и оттуда перемещаться в портальные лимфатические сосуды. Эпителиальные клетки желчных протоков тоже могут проявлять иммунологическую активность, как и энтероциты, путем экспрессии ГКГ II класса и действуя как АПК.
У собак и кошек желчь чрезвычайно богата иммуноглобулином IgA; однако, не много известно о способе и значении секреции билиарного IgA у этих видов. У других видов животных (например, грызунов) часть билиарного IgA имеет местное происхождение, но большая часть производится слизистой оболочкой кишечника, затем абсорбируется в кровоток и с током крови попадает в желчь через гепатоциты путем связывания IgA с plgR гепатоцитов. У человека этот механизм практически не представлен из-за незначительной экспрессии plgR в печени.
В дополнение к способности развивать активный иммунный ответ печень является важной зоной реализации иммунологической толерантности к множеству антигенов, в том числе антигенов пищевых продуктов, попадающих в печень через систему воротного кровотока.
При запуске механизма толерантности важная роль может принадлежать синусоидальным эндотелиальным клеткам печени, презентирующим антигены лимфоидным популяциям печени. Среда, формирующая толерантность, насыщается регуляторными цитокинами IL-10 TGFß, которые продуцируются клетками Купфера, синусоидальными эндотелиальными клетками и клетками Ито. Это состояние «пассивности» или иммунологической толерантности печени может явиться причиной ряда феноменов:
- Долговременная поддержка аллотрансплантатов печени.
- Быстрая приживаемость опухолевых метастазов в печени.
- Персистирование некоторых инфекций печени.
Ссылки и дополнительная литература:
1.Crispe IN (2003) Hepatic Т cells and liver tolerance. Nature Reviews Immunology 3, 51-62
2. Day MJ (1998) Immunohistochemical characterization of the lesions of feline progressive lymphocytic cholangitis/ cholangiohepatitis. Journal of Comparative Pathology 119, 135-147
3. German A, Bland PW, Hall EJ and Day MJ (1998) Expression of major histocompatibility complex class II antigens in the canine intestine. Veterinary Immunology and Immunopathology 61,171-180
4. German AJ, Hall EJ and Day MJ (1999) Analysis of leucocyte subsets in the canine intestine. Journal of Comparative Pathology 120, 129-145
5. German AJ, Hall EJ and Day MJ (2000) Relative deficiency in IgA production by duodenal explants from German shepherd dogs with small intestinal diseases. Veterinary Immunology and Immunopathology 76, 25-43
6. German AJ, Hall EJ and Day MJ (2003) Chronic intestinal inflammation and intestinal disease in dogs. Journal of Veterinary Internal Medicine 17, 8-20
7. German AJ, Hall EJ, Moore PF, Ringler DJ, Newman W and Day MJ (1999) Analysis of the distribution of lymphocytes expressing aß and уб T cell receptors and expression of mucosal addressin cell adhesion molecule-1 in the canine intestine. Journal of Comparative Pathology 121, 249-163
8. Harley R, Gruffydd-JonesTJ and Day MJ (2003) Salivary and serum immunoglobulin level in cats with chronic gingivostomatitis. Veterinary Record 152,125-129
Дата добавления: 2024-03-05; просмотров: 1674;











