Формальная кинетика гомогенных реакций
Большинство гомогенных реакций имеют сложный механизм и протекают через ряд последовательных стадий, каждая из которых представляет собой моно-, би- или тримолекулярную элементарную реакцию. Как правило, скорость превращения промежуточных веществ велика. Общая скорость реакции будет определяться скоростью самой медленной стадии (лимитирующая стадия сложной химической реакции). В этом случае зависимость скорости сложной реакции от концентрации реагирующих веществ может быть описана законом действующих масс. Такие сложные реакции называются формально простыми. Но показатели степени в общем случае не равны стехиометрическим коэффициентам. Так, для формально простой гомогенной реакции nAA + nBB ® nDD + nEE зависимость скорости реакции от концентрации реагентов определяется уравнением
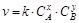 x¹nA; y¹nB.
x¹nA; y¹nB.
Такое уравнение называется кинетическим уравнением реакции.
Показатели степени в данном случае называются порядком реакции. Каждый из показателей степеней (x; y) называется порядком реакции по соответствующему компоненту, а сумма всех показателей (x + y) – кинетическим порядком реакции. Порядок реакций по компонентам определяется экспериментально.
В общем случае кинетический порядок реакции и порядок по компонентам может быть целым или дробным числом. В некоторых случаях, например в фотохимических реакциях, скорость реакции не зависит от концентрации реагирующих веществ и порядок реакции является нулевым.
Отметим, что для элементарных реакций молекулярность реакции и кинетический порядок численно совпадают, а порядок по компонентам совпадает со стехиометрическими коэффициентами в уравнении реакции. Также необходимо отметить, что в этом случае определение скорости реакции как числа элементарных актов в единицу времени в единице реакционного пространства теряет физический смысл. Для формально простых реакций скорость определяется через изменение количества исходных веществ и продуктов реакции в единицу времени.
При протекании химической реакции происходит превращение одних веществ в другие, в ходе которого количество исходных веществ уменьшается, а количество продуктов реакции возрастает. Изменение количества i-го вещества (Dni число молей) в единицу времени (Dt) в единице реакционного пространства (R) называется скоростью реакции по i–му компоненту (скоростью образования или расходования i–го вещества):
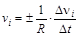 при Dt®0
при Dt®0 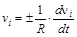 .
.
Изменение числа молей Dni продуктов реакции положительно, а исходных веществ отрицательно. Изменения количеств каждого из реагентов не являются независимыми, а связаны между собою стехио-метрическими коэффициентами. Так, для реакции nAA + nBB ® nDD + nEE
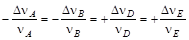 .
.
Следовательно, величина 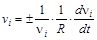 не зависит от выбора реагента, изменение количества которого во времени наблюдают. Таким образом, она однозначно характеризует скорости превращения всех веществ в ходе химической реакции – скорость реакции в целом.
не зависит от выбора реагента, изменение количества которого во времени наблюдают. Таким образом, она однозначно характеризует скорости превращения всех веществ в ходе химической реакции – скорость реакции в целом.
Пример.Экспериментально определенное кинетическое уравнение реакции взаимодействия иодистого водорода с перекисью водорода 2HI + H2O2 ® 2H2O + I2 имеет вид 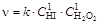 .
.
Несовпадение порядков реакции по компонентам со стехиометрическими коэффициентами связано с тем, что данная реакция является сложной и протекает через ряд промежуточных стадий. Например:
1) H2O2 ® 2OH·,
2) OH· + HI ® H2O + I·,
3) I· + I· ® I2.
Практический интерес представляет зависимость концентрации реагирующих веществ от времени протекания реакции (изменение концентрации во времени: C=f(t)).
Поскольку скорость реакции является первой производной изменения концентрации во времени, то кинетическое уравнение есть дифференциальное уравнение, решением которого и является функция C=f(t):
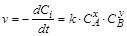 .
.
Дата добавления: 2020-02-05; просмотров: 801;











