Связей. Промежуточные частицы и их свойства
Природа ковалентной связи. В основе химической связи лежит электростатическое притяжение положительно заряженных ядер к электронной паре, осуществляющей связь. Электронная пара за счет электростатических сил удерживает положительно заряженные атомы. В ковалентных связях электроны связи (электронные пары) находятся “в совместном владении обоих атомов”. В неполярных ковалентных связях электроны связи располагаются на равных расстояниях от атомов, а в полярных – смещены к одному из них в результате различной электроотрицательности атомов, или вследствие действия электронных эффектов внутри молекулы. Неполярные ковалентные связи – прочнее, разрываются с трудом, только в жестких условиях – при высокой температуре или под воздействием промежуточных частиц с высокой энергией – радикалов. При разрыве неполярной ковалентной связи двух электронное облако связи делится симметрично, электроны локализуются на атомах со свободной валентностью. Это - гомолитический разрыв связи, [8, c.49]. Образующиеся частицы – радикалы. Радикал – атом или группа атомов с неспаренным элетроном на одном из них. Легкость образования радикалов возрастает с увеличением числа заместителей на атоме углерода с неспаренным электроном. Радикалы – высокоактивные частицы, которые легко вступают в химические превращения. Время их жизни составляет тысячные доли секунды. В приведенном ряду радикалов: метильный < первичный (например, этильный) < вторичный (например, изо-пропильный) < третичный (например, трет-бутильный) наблюдается следующее изменение свойств - растет время жизни радикалов, падают их энергия и реакционная способность, растет вероятность образования в ходе реакции. Так, например, реакции алканов протекают по радикальному механизму через образование промежуточных частиц – радикалов. Реакции начинаются с гомолитического разрыва С-Н связи при атоме углерода с наибольшим числом заместителей, т.е. начинаются через образование наиболее устойчивых с большим числом заместителей при атоме углерода с неспаренным электроном радикалов (см. ниже ряды стабильности промежуточных частиц).
Полярные связи разрываются несимметрично. Электронная пара связи не разделяется, а целиком уходит с более электроотрицательным атомом - это гетеролитический разрыв ковалентной связи, [8, c.50]. Промежуточные частицы, образующиеся при гетеролитическом разрыве – ионы (катионы и анионы). Стабильность карбкатионов (ионов, несущих положительный заряд на атоме углерода со свободной валентностью) возрастает с увеличением числа заместителей на положительно заряженном углероде. Объясняется это тем, что в результате действия +Jэф алкильных групп (см. раздел 3.1.3), величина положительного заряда катионов уменьшается с увеличением числа алкильных заместителей. Поэтому свойства катионов изменяются в приведенном выше ряду в той же последовательности, что и в случае с радикалами. В карбанионах (в них на атоме углерода со свободной валентностью в виде неподеленной электронной пары локализован отрицательный заряд) свойства изменяются в обратной последовательности, т.к. +Jэф алкильных групп увеличивает отрицательный заряд на атоме углерода карбаниона:
Ряды стабильности промежуточных частиц
(радикалов, катионов, анионов):
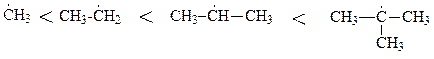
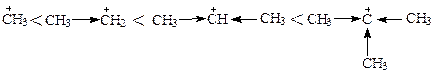
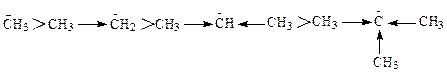
Самопроизвольные превращения свободных радикалов - рекомбинация, диспропорционирование, распад по β-связи.Радикалы – высоко реакционноспособные частицы. Они либо атакуют молекулы органических веществ, либо претерпевают самопроизвольные превращения - рекомбинацию и гомолитический распад по β-связи. β-Связи – все связи, образуемые β-углеродным атомом. Распад по βС-С-связи называют «β-распад», а по βС-Н-связи – «диспропорционирование».
Радикалы, образующиеся при β-распаде либо внутримолекулярно рекомбинируют (в случае бирадикалов) с образованием π-связи, либо рекомбинируют друг с другом (монорадикалы) в произвольных сочетаниях. Пример самопроизвольных превращений пропильного радикала:
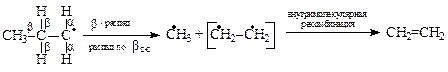
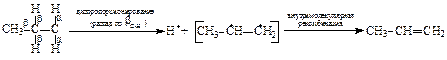
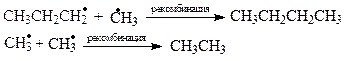
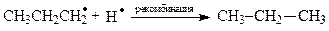
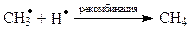
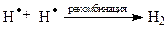
ТЕМА 3
Дата добавления: 2016-06-15; просмотров: 2020;











