Общие сведения о металлах и сплавах 3 глава
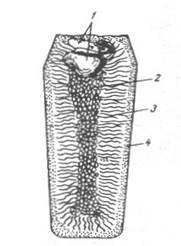
Рис. 7. Структура отливки
1 – усадочная раковина, 2 - зона неориентированных зерен, 3 – кристаллизационная зона с ориентированными кристаллами, 4 – корковый слой с мелкими зернами
Наличие усадочной раковины характерно для спокойной стали, поэтому ее обычно разливают сверху, за счет чего уменьшается высота усадочной раковины.
Слиток кипящей стали характеризуется отсутствием усадочной раковины и обилием газовых пузырей. Наличие газовых пузырей не является серьезным дефектом слитка, т.к. при соответствующей степени обжима слитка в процессе прокатки стенки пузыря будут заварены.
Контрольные вопросы
1. Что называют сталью? 2. Что является сырьем для получения стали? 3. В чем сущность процесса получения стали? 4. В каких агрегатах получают сталь и каковы принципы их работы? 5. Какие существуют способы разливки стали?
3. Металловедение
Для рассмотрения строения, превращений и свойств металлов и сплавов введем понятия «фаза» и «структура».
Фаза – однородная часть металла или сплава, имеющая одинаковый состав, кристаллическое строение и свойства и отделенная от остальных частей системы поверхностью раздела.
Структура – строение металла или сплава. Кристаллические тела в отличие от аморфных дают зернистый излом, по которому можно судить о размере зерна, термообработке и некоторых свойствах металла: крупный зернистый излом отвечает обычно худшим механическим свойствам, чем мелкозернистый.
3.1. Строение металлов
Технические металлы в твердом виде состоят из прочно связанных в одно целое кристаллических зерен, расположенных хаотически.
Характерным признаком кристаллического строения металлов является правильное расположение атомов в каждом отдельном кристалле металла. Атомы в кристаллах находятся на определенных расстояниях друг от друга, образуя пространственную кристаллическую решетку (дальний порядок размещения атомов).
Кристаллическая решетка – воображаемая пространственная сетка, в узлах которой располагаются атомы (ионы), образующие металл.
Для однозначной характеристики кристаллической ячейки необходимо знать: три ребра (a,b,c) и три угла между осями (α,β,γ). Исходя из соотношений между осевыми единицами все пространственные решетки делятся на 7 систем (сингоний):
1) a=b=c; α=β=γ=90° – кубическая;
2) a=b≠c; α=β=γ=90° – тетрагональная;
3) a≠b≠c; α=β=γ=90° – ромбическая;
4) a=b≠c; α=β=90°; γ=120° – гексагональная;
5) a=b=c; α=β=γ≠90° – ромбоэдрическая;
6) a≠b≠c; α=γ=90°; β≠90° – моноклинная;
7) a≠b≠c; α≠β≠γ≠90° – триклинная.

Рис. 8. Элементарная ячейка
Кристаллические решетки, в которых атомы расположены в вершинах – простые, а если атомы расположены в вершинах и внутри ячеек или на их границах – сложные.
Пространственная кристаллическая решетка любого металла слагается из бесчисленного множества сопряженных друг с другом элементарных ячеек, внутри которых в известном порядке размещаются отдельные атомы (ионы).
Основными видами элементарных ячеек большинства металлов являются:
1) простая кубическая (п.к.)
2) объемноцентрированная кубическая (о.ц.к.)
3) гранецентрическая кубическая (г.ц.к.)
4) гексагональная
1 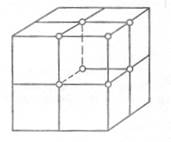 2
2 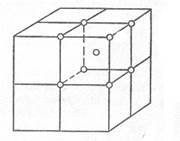 3
3 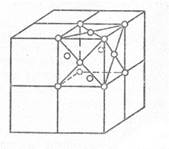 4
4 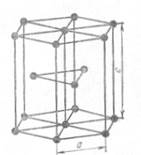
Рис. 9. Виды элементарных ячеек
Расстояние «а» между центрами атомов, расположенных в узлах ячейки, называют периодом решетки (измеряется в ангстремах, 1Å=1·10-8 см).
Другими характеристиками решетки являются:
1) плотность упаковки – число атомов, приходящееся на одну элементарную ячейку (в простой кубической ячейке 8 атомов, но ее окружает еще 8 ячеек, т.е. каждый атом принадлежит 8 ячейкам, тогда на 1 ячейку приходится 1 атом, для о.ц.к. решётки плотность упаковки = 2, для г.ц.к. = 4);
2) координационное число – число атомов, находящихся на равном и наиболее близком расстоянии от избранного.
Вследствие неодинаковой плотности атомов в различных направлениях многие свойства (физические, химические, механические) кристалла зависят от направления. Подобная неодинаковость свойств монокристалла в разных направлениях называется анизотропией. Кристалл – анизотропное тело в отличие от изотропных аморфных тел, свойства которых не зависят от направления.
Металлы – поликристаллы, т.е. состоят из огромного числа анизотропных кристаллов (0,001…0,1 мм), различно ориентированных друг к другу, поэтому во всех направлениях свойства металла более или менее одинаковы, т.е. поликристаллическое тело является изотропным. Такая мнимая изотропность металла не будет наблюдаться, если кристаллы имеют одинаковую ориентировку, например, возникшую при холодной деформации; в этом случае металл приобретает анизотропность.
Впервые на связь между строением металлов и сплавов и их свойствами обратили внимание русские металлурги П.П.Аносов (1799-1851 г.г.) и Д.К.Чернов (1839-1921 г.г.). Для исследования строения металлов П.П.Аносов использовал микроскоп, Д.К. Чернов установил связь между строением, свойствами и термообработкой металлов. Труды этих ученых составляют основу современного металловедения.
Первое подробное описание структур железоуглеродистых сплавов было сделано Ржешетарским (1898 г.). Дальнейшее развитие металловедение получило в трудах отечественных ученых: Беляева, Курнакова, Байкова, Штейнберга и др. Из иностранцев наиболее известны работы Аустена и Сорби (Англия), Осмонда и Ле-Шателье (Франция), Мартенса и Рейна (Германия), Совера (США), Хонда (Япония).
Установление зависимости между строением металлов и их свойствами послужило толчком к дальнейшим исследованиям строения металла. Сейчас для этого используются рентген, электронный микроскоп, термический анализ. Современное металловедение использует данные атомной физики, что позволяет глубже понять природу строения металлов и указывает новые пути повышения механических свойств металлов и сплавов, применяемых в технике.
Многие особые свойства металлов (электро- и теплопроводность) определяются особенностями их внутриатомного строения. Принадлежащие атому электроны разделяются на валентные (внешние) и внутренние, движущиеся на более близких к ядру орбитах. Валентные электроны слабо связаны с ядром и могут подвергаться воздействию положительно заряженных ядер близлежащих атомов, поэтому их можно назвать свободными электронами.
Строение реальных кристаллов металлов в отличие от идеальных характеризуются большим количеством дефектов, влияющих на свойства металлов (для монокристалла железа минимальная теоретическая прочность сдвига 23000 МПа, а фактическая 400 МПа, для алюминия фактическая прочность почти в 500 раз меньше теоретической). Дефекты появляются в результате образования атомных дырок а (вакансий), внедрения инертных атомов б и перемещения атома в в междоузлие. Дефекты, распространяющиеся на большую длину, называются дислокациями (рис.10).
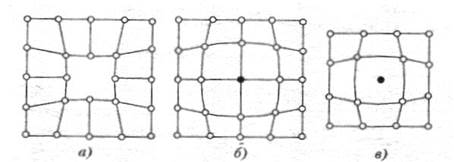
Рис. 10. Виды дислокаций
3.2. Кристаллизация металлов
Переход металла из твердого состояния в жидкое происходит при строго определенной температуре (температуре плавления), тогда как аморфные вещества не имеют строго определенной температуры. И наоборот, переход металла из жидкого состояния в твердое происходит также при фиксированной температуре – температуре кристаллизации, которая равна температуре плавления.
|
|
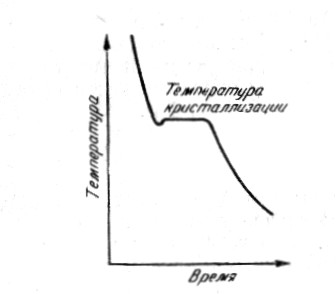
Рис. 11. Схема кристаллизации расплавленного металла
Точка m – возникновение при определённой температуре первых центров кристаллизации, количество которых увеличивается по мере отвода тепла. Ранее возникшие кристаллы увеличиваются до тех пор, пока весь металл не затвердеет (n). Этот процесс сопровождается выделением скрытой теплоты кристаллизации, поэтому t ºС = const..
Кристаллизацией называется процесс образования кристаллов из жидкой или газообразной фазы. При быстром охлаждении металл может некоторое находиться в жидком состоянии при температуре ниже температуры кристаллизации. Разность между теоретической tт при медленном охлаждении и фактической tф температурами кристаллизации называется степенью переохлаждения:
Δt = tт - tф.
Интенсивность кристаллизации (как установил Г.Тамман) зависит от степени переохлаждения и характеризуется:
1) скоростью зарождения – числом центров кристаллизации (ц.к.), зарождающихся в единице объема металла в единицу времени (мм-3·сек-1);
2) скоростью роста (с.к.) – скоростью увеличения линейных размеров растущей грани кристалла в единицу времени (мм/сек).
Зависимость этих характеристик от степени переохлаждения приведена на рис.12:
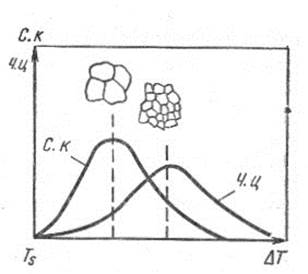
Рис. 12. Зависимость кристаллизации от скорости переохлаждения
Число центров кристаллизации и скорость роста с увеличением Δt увеличиваются, достигают максимума и уменьшаются до нуля. При малой степени переохлаждения Δt скорость роста велика, а скорость зарождения мала – в результате металл будет иметь крупнокристаллическое строение.
При большей степени переохлаждения скорость роста меньше скорости зарождения – мелкокристаллическое строение металла. Поскольку кристаллизация начинается одновременно в разных точках объема, рост кристаллов правильной формы постепенно нарушается вследствие столкновения кристаллов между собой. В результате образуется множество кристаллов неправильной формы – кристаллиты.
3.3. Аллотропические превращения
Некоторые металлы (железо, олово, титан, цирконий, кобальт и др.) в твердом состоянии способны к аллотропическим или полиморфным превращениям, т.е. могут переходить при охлаждении или нагревании из одной кристаллической формы в другую (перекристаллизация).
Аллотропические превращения железа можно проследить по кривым охлаждения и нагревания:
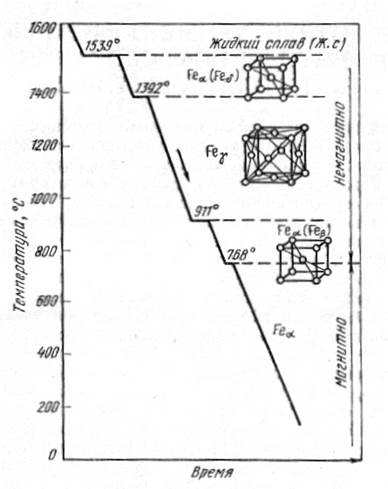
Рис. 13. Схема полиморфных превращений железа
Переход железа из одной формы в другую сопровождается выделением тепла - горизонтальной площадке, а при нагреве – поглощением тепла.
На кривой охлаждения при 1539ºС появляется первая горизонтальная площадка, соответствующая переходу железа из жидкого состояния в твердое Feδ с выделением тепла. Feδ – кубическая объемно-центрированная решетка с а=2,93 Å и координационным числом 8.
При 1390ºС Feδ переходит в Feγ с кубической гранецентрированной решеткой, что сопровождается уменьшением объема.
При 898ºС Feγ переходит в Feβ с кубической объемно-центрированной кристаллической решеткой и сопровождается увеличением объема, т.к. в Feβ атомы расположены менее тесно.
При 768ºС Feβ переходит в Feα. Переход состоит во внутриатомных превращениях, в результате которых у Feα появляются магнитные свойства, а кристаллическая решетка остаётся как у Feβ.
При нагреве железа превращения совершаются в обратном порядке.
Важное значение для термообработки имеет свойство Feγ давать с углеродом твердые растворы. Наибольшая растворимость углерода в Feγ (до 1,7%) наблюдается при t=1130ºС. При повышении и понижении температуры от 1130ºС растворимость углерода в Feγ понижается. Твердый раствор углерода и других элементов в Feγ называется аустенитом.
Feα не образует с углеродом устойчивых твердых растворов подобных аустениту. Растворимость углерода в Feα ничтожна. Твердые растворы небольших количеств углерода в Feα называют ферритом.
Полиморфное превращение носит кристаллизационный характер и осуществляется путем образования зародышей и последующего их роста в результате перехода атомов из старой модификации в новую. Зародыши новой модификации чаще возникают на границах зерен исходных кристаллитов. В результате образуются новые кристаллические зерна, имеющие другой размер и форму – перекристаллизация. Изменение компактности кристаллической решетки при переходе из одной полиморфной формы в другую влечет изменение объема вещества, что оказывает большое влияние на изменение размеров и формы стальных деталей при их термообработке.
3.4. Двойные сплавы
В технике широко применяют не чистые металлы, а сплавы, обладающие металлическими свойствами и состоящие из двух и более компонентов.
Однородные составные части сплава называются фазами. Фазами системы могут быть чистые элементы (в виде механической смеси), химические соединения и твердые растворы.
Механическая смесь компонентов А и В образуется в том случае, если они неспособны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения. При этих условиях сплав будет состоять из кристаллов А и В со свойственными им решетками. Особенностью таких сплавов является то, что температура плавления сплава определённого состава будет минимальной. Сплавы такого состава называются эвтектическими или эвтектикой и могут образовываться не только чистыми металлами, но и другими фазами. В зависимости от числа компонентов эвтектики могут быть двойными, тройными и т.д. Например, ледебурит – смесь цементита и аустенита (Fe + 4,3% С)
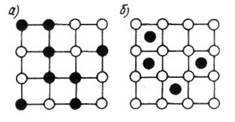
Рис.14. Виды твёрдых растворов, а – замещения, б – внедрения
При образовании химического соединения компоненты А и В имеют общую кристаллическую решетку, отличающуюся от каждой из решеток сплавляемых компонентов. В химическом соединении существует строго определенное соотношение атомов исходных элементов, поэтому его состав можно выразить химической формулой AnBm (цементит Fe3C).
Твердый раствор – однородное твердое тело, состоящее из атомов взаиморастворимых элементов. В отличие от механической смеси твердый раствор является однофазным, имеет общую кристаллическую решетку, а в отличие от химического соединения твердый раствор существует не при строгом определенном соотношении исходных компонентов и сохраняет кристаллическую решетку одного из компонентов.
В твердых растворах замещения растворение компонента В в металле А происходит путем частичного замещения атомами растворенного металла В атомов в решетке металла-растворителя А. твердые растворы замещения образуются в сплавах железо+никель, железо+марганец, железо + хром, медь+никель и т.д.
Твердые растворы внедрения образуют кристаллическую решетку, в которой атомы растворенного вещества В располагаются между атомами металла-растворителя А (сплавы железо+углерод).
3.5. Диаграммы состояния
Рассмотрение диаграмм состояния сплавов позволяет определить фазовые превращения при понижении температуры расплава в условиях очень медленного охлаждения при всех соотношениях сплавляемых компонентов. Эти диаграммы характеризуют окончательное состояние сплавов, т.е. полученное после окончания всех превращений и полного окончания кристаллизации.
Это состояние сплава характеризуется числом и концентрацией образовавшихся фаз и зависит от внешних условий (температуры и давления). Закономерность изменения числа фаз в сплаве определяется правилом фаз, которое устанавливает зависимость между числом степеней свободы (С), числом компонентов (К) и число фаз (Ф):
С = К + 2 – Ф,
где 2 – число внешних факторов (давление и температура).
Под числом степеней свободы понимают возможность изменения температуры и давления без изменения числа фаз, находящихся в равновесии.
Пример: сплав из двух компонентов при затвердевании является двухкомпонентной и двухфазной системой. В этом случае, С=2 и, следовательно, можно (в определенных пределах) изменять температуру и давление без изменения числа фаз, т.е. состояния сплава. Такой сплав кристаллизуется в определённом интервале температур.
В процессе кристаллизации меняется не только состав фаз, но и количественное соотношение между ними. Чем ниже температура, тем больше будет твердой фазы и меньше жидкой. Для определения количественного соотношения между фазами, находящимися при данной температуре в равновесии, пользуются правилом рычага: для определения весового или объемного количества твердой фазы необходимо взять отношение длины отрезка ( 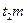 ), примыкающего к составу жидкой фазы к длине всей коноды (
), примыкающего к составу жидкой фазы к длине всей коноды ( 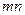 ). Для определения же количества жидкой фазы берется отношение длины отрезка, примыкающего к составу твердой фазы (
). Для определения же количества жидкой фазы берется отношение длины отрезка, примыкающего к составу твердой фазы ( 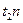 ) к длине коноды. Следовательно, количество твердой и жидкой фаз в процентах определится соотношениями:
) к длине коноды. Следовательно, количество твердой и жидкой фаз в процентах определится соотношениями:
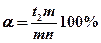
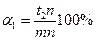
При общем весе сплава Q
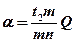
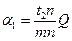
Если рассматривать процессы затвердевания сплавов в условиях медленного охлаждения, при котором все превращения успевают полностью закончиться, то строение сплавов можно представить на диаграммах состояний. Принципы построения диаграммы рассмотрим на примере системы Pb-Sb (свинец – сурьма) (рис.15).
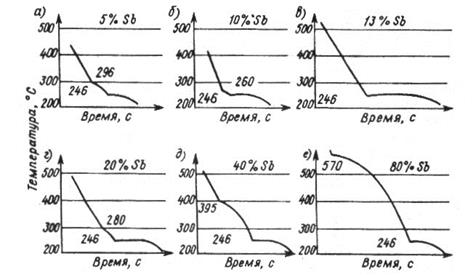
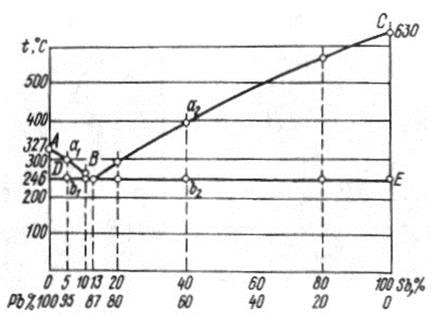
Рис. 15. Построение двухкомпонентной диаграммы свинец – сурьма (Pb – Sb)
На кривых охлаждения чистых металлов (Pb и Sb) имеется по одной критической точке, соответствующей переходу металла из жидкого состояния в твердое (для свинца 327 ºС, для сурьмы 630 ºС). Ниже этих температур они находятся в твердом состоянии. На кривых же охлаждения сплавов Pb-Sb имеются не одна, а две критических точки, соответствующие началу и концу их затвердевания.
Затвердевание сплавов Pb-Sb, содержащих менее 13% сурьмы, начинается при температурах, соответствующих верхним критическим точкам, с выпадением кристаллов свинца. При снижении температуры количество кристаллов свинца увеличивается, а остающаяся жидкость обогащается сурьмой. Как только концентрация сурьмы достигнет в жидкости 13% начнется одновременная кристаллизация сурьмы и свинца с образованием эвтектики (t=246ºС).
На кривой охлаждения сплава (87% свинца и 13% сурьмы) имеется лишь одна критическая точка 246ºС, т.е. такой сплав состоит только из эвтектики. Затвердевание сплавов с большим (чем 13%) содержанием сурьмы начинается с выпадением кристаллов сурьмы и при достижении 13% Sb в жидкости, последняя затвердевает, образуя эвтектику (t=246ºС).
Чтобы получить диаграмму состояний сплавов верхние и нижние критические точки переносят на координационные оси «tºС – состав сплава».
Линия АВС – геометрическое место критических точек начала затвердевания расплава (линия ликвидус) – выше этой линии сплавы находятся в жидком состоянии. Линия DВЕ – геометрическое место точек конца затвердевания (линия солидус) – ниже нее сплавы находятся в твердом состоянии.
Сплавы с содержанием сурьмы меньше 13% – доэвтектические. В интервале температур между линиями ликвидус и солидус они состоят из кристаллов свинца и жидкости, а ниже линии солидус – из кристаллов свинца и эвтектики.
Сплавы с содержанием сурьмы больше 13% – заэвтектические и состоят из кристалло сурьмы и расплава между линиями солидус и ликвидус и из кристаллов сурьмы и эвтектики – ниже линии солидус.
В твердом состоянии все сплавы Pb-Sb состоят из двух фаз – кристаллов сурьмы и свинца, т.к. сложная структурная составляющая – эвтектика – состоит из тех же фаз.
Рассмотренная диаграмма состояния сплавов Pb-Sb относится к диаграммам состояний I типа. Этот тип диаграмм относится и к другим системам сплавов, компоненты которых неограниченно растворяются друг в друге в жидком состоянии и нерастворимы в твердом состоянии.
II тип диаграмм состояния характеризуется тем, что компоненты неограниченно растворяются в жидком и твердом состояниях друг в друге и образуют однородные твердые растворы (разность периодов решеток не более 8%, компоненты обладают близкими химическими свойствами, т.е. рядом расположены в периодической системе элементов). Такие диаграммы состояния получаются при сплавлении меди Cu с никелем Ni, кобальта Co с никелем Ni, железа Fe с никелем Ni, железа Fe с хромом Cr, кобальта Co с хромом Cr.
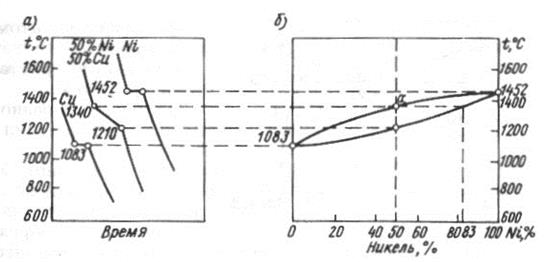
Рис. 16. Построение двухкомпонентной диаграммы медь – никель (Cu – Ni)
Выше линии ликвидуса находится жидкий сплав. Кристаллизация сплавов начинается с выпадения из жидкого раствора кристаллов твердого раствора. Состав жидкой фазы при понижении температуры изменяется по линии ликвидус, твердой – солидус. В момент окончания кристаллизации (при достаточной скорости диффузии) концентрация твердого раствора становится равной исходной концентрации сплава. Особенностью диаграммы II типа является отсутствие эвтектического сплава.
III тип диаграммы состояний характеризуется тем, что в жидком состоянии компоненты неограниченно растворены друг в друге, а в твердом имеют ограниченную растворимость и при кристаллизации образуют эвтектику.
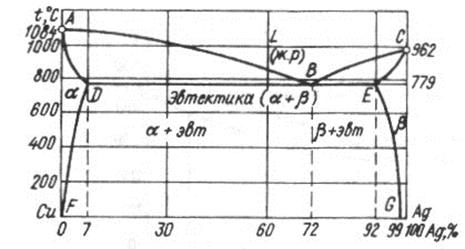
Рис. 17. Двухкомпонентная диаграмма медь – серебро (Cu – Ag)
Кристаллизация доэвтектических сплавов по линии АВ начинается с выделения твердого раствора α (твердый раствор компонента В в растворителе А). Кристаллизация заэвтектических сплавов по линии ВС начинается с выделения из жидкой фазы кристаллов твердого раствора β (твердый раствор компонента А в растворителе В).
Состав твердых растворов с понижением температуры меняется по линии ADВЕС. Максимальная растворимость компонента В в А соответствует точке D, а максимальная растворимость компонента А в В соответствует точке Е при эвтектической температуре.
Линии DF и EG показывают, что растворимость компонентов В в А и А в В уменьшается с остыванием. Поэтому из твердых растворов выделяются избыточные фазы. Из твердого раствора α выделяются кристаллы твердого раствора βII (данная структура образовалась при вторичной кристаллизации, т.е. из твердого раствора α).
Сплавы, имеющие состав точки B, являются эвтектическими. Эвтектика состоит из тонкой механической смеси двух твердых растворов α и β.
Доэвтектические сплавы состоят из кристаллов твердого раствора α, эвтектики α+β и мелких вторичных кристаллов твердого раствора βII. Заэвтектические – из кристаллов твердого раствора β, эвтектики α+β и мелких вторичных кристаллов αII.
IV тип диаграммы состояния характеризуется тем, что в жидком состоянии компоненты полностью растворимы, а при затвердевании образуют устойчивое химическое соединение.
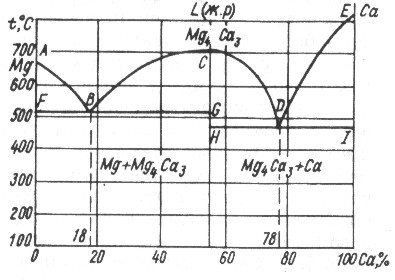
Рис. 18. Двухкомпонентная диаграмма 4 типа магний – кальций (Mg – Ca)
Рассмотрим диаграмму состояния системы, состоящей из компонентов А и В, которые образуют устойчивые химическое соединение AmBn. Температура плавления его может быть выше или ниже температуры плавления исходных компонентов. В связи с этим диаграмму состояния следует рассматривать, как состоящую из двух диаграмм первого типа.
Затвердевание системы А – AmBn идет по линии AВС, по линии AВ кристаллизуется компонент А (магний на рис.17), а по линии ВС– AmBn (Mg4Ca3) . окончательное затвердевание системы происходит при эвтектической температуре по линии FBG. В точке В одновременно кристаллизуются А и AmBn (эвтектика) .
3.6. Железоуглеродистые сплавы
Железо легко сплавляется со многими элементами, в технике применяют сплавы железа с углеродом, кремнием, марганцем, хромом, никелем и другими элементами. Железоуглеродистые сплавы находят широкое применение в строительстве, если в сплаве содержится до 2% углерода, то его называют сталью, а если более 2%, то чугуном.
После затвердевания различают несколько структурных составляющих железоуглеродистых сплавов:
1) Феррит (Ф) – твердый раствор внедрения углерода в α-железо. Он мягкий (65..130 НВ), пластичный (δ = 40%), сильно магнитен, хорошо проводит тепло и электричество. При нормальных температурах в феррите 0,002% углерода, максимальное содержание 0,1% углерода при t = 727 ºС. Кристаллическая решетка феррита – кубическая, объемно-центрированная, с координационным числом 8, т.е. такая же как у чистого α-железа. Температура плавления 1539 ºС.
2) Цементит (Ц) – химическое соединение Fe3C, содержит 6,67% углерода. Имеет металлический блеск, обладает большой твердостью (примерно 800 НВ) и хрупкостью. Слабо магнитен, плохо проводит тепло и электричество, температура плавления 1560ºС. Цементит неустойчив и при высоких температурах распадается:
Fe3C→3Fe + С
3) Аустенит (А) – твердый раствор внедрения углерода в γ-железе, имеет гранецентрированную решетку с координационным числом 12. Аустенит не магнитен, мягкий (170..200 НВ), максимальная растворимость углерода в аустените 2% при 1147 ºС. При температуре ниже 727 ºС переходит в перлит.
4) Перлит (П) – эвтектоид (так как образуется не из расплава, а из твёрдого аустенита), механическая смесь феррита и цементита. Содержит 0,8% углерода. Механические свойства зависят от формы и степени измельченности частичек входящего в него цементита (НВ до 160).
5) Ледебурит (Л) – механическая смесь аустенита и цементита, содержащая 4,3% углерода. Он образуется из жидкого расплава (эвтектики) при 1147 ºС. В интервале температур 1147…727ºС – механическая смесь аустенита и цементита, а ниже 727 ºС состоит из феррита и цементита. Ледебурит отличается высокой твердостью (700 НВ) и хрупкостью.
Диаграмма состояния Fe-С включает все сплавы, имеющие практическое применение. Максимальное содержание углерода в сплавах равно 6,67%. Сплавы с большим содержанием углерода не применяются, т.к. получать их весьма трудно из-за большой тугоплавкости и малой прочности.
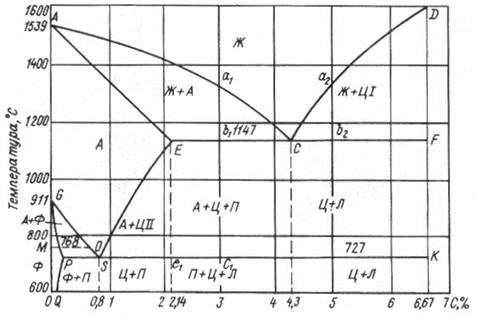
Рис. 19. Диаграмма состояния железо – углеродистых сплавов (Fe – C)
При построении диаграммы состояния произведены некоторые упрощения, чтобы выяснить общие закономерности, не загромождая схему линиями и точками, нанесенными на полной диаграмме состояния Fe-С.
Дата добавления: 2020-02-05; просмотров: 768;











