Ультраструктура миокарда
СЕРДЕЧНО-СОСУДИСТАЯ ПАТОЛОГИЯ
В настоящее время нет необходимости объяснять причины того большого интереса, который проявляется медиками и биологами к проблемам сердечно-сосудистой патологии. Широкая распространенность заболеваний сердца и сосудов, приводящая к гибели огромного количества людей во всем мире, является исключительно сильным стимулом в развитии исследований в области патологии кровообращения. В наиболее развитых странах от сердечно-сосудистых заболеваний погибает максимальное количество людей. Так, в США от атеросклероза и его осложнений ежегодно умирает более 600 тыс. человек, в России — около 400 тыс. Борьба с инфарктом миокарда, гипертонической болезнью, ишемической болезнью сердца является проблемой первостепенной важности в современной медицине.
Как известно, все названные формы патологии обязаны своим происхождением нарушению регуляции функций сердца и сосудов.
РЕГУЛЯТОРНЫЕ И МЕТАБОЛИЧЕСКИЕ ХАРАКТЕРИСТИКИ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
Аппарат кровообращения принято условно разделять на три составляющих:
1) сердце—генератор энергии;
2) сосуды, свойствами которых определяется расход этой энергии и возврат крови к сердцу и
3) регуляторный аппарат, производящий постоянную коррекцию деятельности сердца и сосудов.
К истинно регуляторному аппарату сердечно-сосудистой системы следует отнести не только специализированные нервные волокна и нейромедиаторы, но и процессы взаимодействия нейрогенного, метаболического, гормонального и миогенного контуров управления.
Для того, чтобы более детально проанализировать механизмы нарушений физиологических характеристик при тех или иных формах патологии, мы сначала отдельно рассмотрим основные функциональные характеристики сердца, сосудистой системы и регуляторного аппарата.
Ультраструктура миокарда
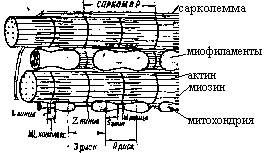
Мышечные волокна сердца состоят из отдельных миоцитов, пересеченных через определенные промежутки вставочными дисками. Плазматическая мембрана миоцитов вместе с базальной мембраной формирует сарколемму (Сл). Через вставочные диски осуществляется электротоническая связь между миоцитами. В нормальных условиях ионная проницаемость вставочных дисков достаточно высока, чтобы обеспечить проведение возбуждения. При гибели одного из соседних миоцитов ионная проницаемость вставочного диска сразу же резко снижается.
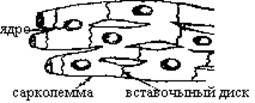
А Б
Рис. 1. Схематизированная структура миокарда в условиях световой (А) и электронной (Б) микроскопии
На границе саркомеров (участков миофибрилл, ограниченных двумя Z-дисками) Сл. образует впячивания Т-системы. В саркоплазме вблизи Т-систем располагаются митохондрии и цистерны саркоплазматическогок ретикулума (СР). Ультраструктурная организация миофибрилл представлена на рис. 1.
Механизм систолы
Согласно теории Г. Хаксли, систола осуществляется благодаря скольжению актиновых протофибрилл вдоль миозиновых. При этом длина протофибрилл заметно не меняется. Активные протофибриллы (АП) втягиваются в анизотропный диск и сближаются в центре Н-зоны, которая исчезает. Миозиновые протофибриллы (МП) доходят до Z-мембраны, что приводит к исчезновению «И» диска (рис. 2). Мышечное сокращение - сложный физико-химический процесс, предусматривающий уменьшение длины саркомеров при сохранении их объема.
Рис. 2. Схема, представляющая
Взаимодействие актина и миозина определяется состоянием регуляторных белков - тропонина и тропомиозина, расположенных между протофибриллами. Регуляторные белки препятствуют образованию актомиозина в покое, снижая АТФ-азную активность миозина (рис. 3).
Потенциал действия проводятся внутрь мышечного волокна Т-системой и вызывают приток кальция внутрь саркоплазмы (СП), а также выброс кальция из цистерн СР и митохондрий (рис. 4). Взаимодействие кальция и тропонина приводит к тому, что молекулы актина становятся доступными для образования связей МП и АП. При ассоциации АП и МП АТФ-азная активность миозина повышается) высвобожденная энергия затрачивается на конформационные изменения молекул миозина, обусловливающих скольжение нитей актина.
Активный перенос кальция через Сл и в цистерны СР приводит к восстановлению тропонинового блока и диастоличеекому расслаблению. Образовавшийся в процессе систолы аденозиндифосфат (АДФ) в момент расслабления вновь фосфорилируется в АТФ за счет креатиндифосфата. В связи с тем, что активный перенос кальция также требует затрат энергии, процесс расслабления не может эффективно осуществляться в отсутствие макроэргических фосфатов. При дефиците энергии сердце останавливается в систоле (на рис. 5-7 представлены последовательные этапы сокращения волокон миокарда и работы «калий-натриевого» насоса).
Дата добавления: 2019-12-09; просмотров: 709;











