Реальные газы. Фазовые равновесия и превращения
Реальный газ – газ, свойства которого зависят от взаимодействия частиц и их собственного объема, что особенно проявляется при высоких давлениях и низких температурах.
Уравнение состояния реальных газов (уравнение Ван-дер-Вааль-са) для произвольной массы газа:
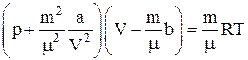 ,
,
где а – поправка Ван-дер-Ваальса на влияние сил межмолекулярного взаимодействия (на внутреннее давление);
b – поправка Ван-дер-Ваальса на собственный объем молекул;
μ – молекулярная масса газа;
m – масса газа.
Внутренняя энергия реального газа состоит из кинетической энергии поступательного и вращательного движения молекул Еk и потенциальной энергии их взаимодействия Еp.
Потенциальная энергия взаимодействия одного моля молекул реального газаимеет отрицательный знак, т.к. молекулярные силы, создающие внутреннее давление p', являются силами притяжения:
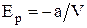 .
.
Изменение потенциальной энергии реального газа (для моля) равно работе, которую совершает внутреннее давление p при расширении газа от объёма V1 до V2:
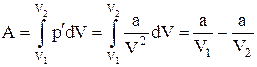 .
.
Кинетическая энергия молекул реального газа (для моля), согласно теореме о равном распределении энергии по степеням свободы (в некотором приближении):
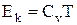 .
.
Дата добавления: 2022-02-05; просмотров: 377;











