Общее число степеней свободы
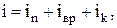
где 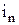 – число степеней свободы поступательного движения;
– число степеней свободы поступательного движения;
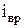 – число степеней свободы вращательного движения;
– число степеней свободы вращательного движения;
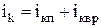 – число степеней свободы колебательного движения;
– число степеней свободы колебательного движения;
iкп – число степеней свободы колебаний точки при поступательном движении;
iквр – число степеней свободы колебаний точки при вращательном движении.
Молекулы газа имеют число степеней свободы:
а) одноатомная – i = 3 (три степени свободы поступательного движения);
б) двухатомная при упругой связи между атомами – i = 6;
в) двухатомная при жёсткой связи между атомами – i = 5;
г) трёхатомная молекула при жёсткой связи между атомами – i = 6.
Теорема о равномерном распределении энергии по степеням свободы: «На любую степень свободы приходится в среднем одинаковая энергия, равная 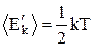 ». Молекула, обладающая i степенями свободы, обладает энергией
». Молекула, обладающая i степенями свободы, обладает энергией
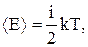
где i = iп + iвр + iк.
Внутренняя энергия произвольной массы газа m равна сумме из энергий отдельных молекул:
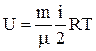 ,
,
где m – молярная масса газа.
Теплоемкость – физическая величина, численно равная количеству теплоты, которое необходимо сообщить веществу для нагревания его на один градус.
Удельная теплоёмкость (c) – физическая величина, численно равная количеству теплоты, которое необходимо сообщить единице массы вещества для нагревания её на один градус.
Молярная теплоёмкость (C) – физическая величина, численно равная количеству теплоты, которое необходимо сообщить одному молю вещества, чтобы увеличить его температуру на один градус:
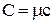 .
.
Удельная теплоёмкость при постоянном объеме (cv) – физическая величина, численно равная количеству теплоты, которое необходимо сообщить единице массы вещества для нагревания её на один градус в условиях постоянного объема:
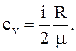
Удельная теплоёмкость при постоянном давлении (cp) – физическая величина, численно равная количеству теплоты, которое необходимо сообщить единице массы вещества для нагревания её на один градус в условиях постоянного давления:
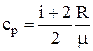 .
.
Молярная теплоёмкость при постоянном объеме (Cv) – физическая величина, численно равная количеству теплоты, которое необходимо сообщить одному молю вещества, чтобы увеличить его температуру на один градус в условиях постоянного объема:
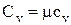 .
. 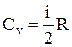 .
.
Молярная теплоёмкость при постоянном давлении (Cp) – физическая величина, численно равная количеству теплоты, которое необходимо сообщить одному молю вещества, чтобы увеличить его температуру на один градус в условиях постоянного давления:
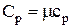 ,
, 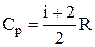 .
.
Отношение молярных и удельных теплоемкостей g:
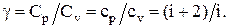
Система – совокупность рассматриваемых тел (в частности, молекул, атомов, частиц).
Параметры состояния системы:p – давление, V – объём, T – температура:
а) интенсивные параметры – параметры (давление, температура, концентрация и др.), не зависящие от массы системы.
Температура – физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. Свойство температуры – определять направление теплового обмена. Температура в молекулярной физике определяет распределение частиц по уровням энергии и распределение частиц по скоростям.
Термодинамическая температурная шкала – температурная шкала, определяемая температура (абсолютная температура) в которой всегда положительна;
б) экстенсивные параметры – параметры (объем, внутренняя энергия, энтропия и др.), значения которых пропорциональны массе термодинамической системы или ее объему.
Внутренняя энергия системы – суммарная кинетическая энергия хаотического движения молекул, потенциальная энергия их взаимодействия и внутримолекулярная энергия, т.е. энергия системы без учёта кинетической энергии её в целом (при движении) и потенциальной энергии во внешнем поле.
Изменение внутренней энергии при переходе системы из состояния в состояние равно разности значений внутренней энергии в этих состояниях и не зависит от пути перехода системы из одного состояния в другое.
Уравнение состояния системы:
F(p,V,T) = 0.
Неравновесное состояние системы – такое, при котором какой–либо из ее параметров состояния системы изменяется.
Равновесное состояние системы – такое, при котором все параметры состояния системы имеют определённые значения, постоянные при неизменных внешних условиях.
Время релаксации – время, в течение которого система приходит в равновесное состояние.
Процесс – переход системы из одного состояния в другое состояние, связанный с изменением хотя бы одного из ее параметров состояния:
а) обратимый процесс – процесс, при котором возможно осуществить обратный переход системы из конечного в начальное состояние через те же промежуточные состояния так, чтобы не осталось никаких изменений в окружающей систему среде;
б) необратимый процесс – процесс, при котором невозможно осуществить обратный переход системы в первоначальное состояние, или если по окончании процесса в окружающей среде или в самой системе произошли какие-либо изменения;
в) круговой процесс (цикл) – такая последовательность превращений, в результате которой система, выйдя из какого-либо исходного состояния, возвращается в него вновь. Любой круговой процесс состоит из процессов расширения и сжатия. Процесс расширения сопровождается работой, совершаемой системой, а процесс сжатия – работой, совершаемой над системой внешними силами. Разность этих работ равна работе данного цикла.
Динамические закономерности –закономерности, подчиняющиеся системам уравнений (в том числе дифференциальных, интегральных и др.), допускающих существование единственного решения для каждого начального условия.
Дата добавления: 2022-02-05; просмотров: 447;











