Равновесия в растворах электролитов
В растворах электролитов присутствуют ионы, подвижность которых, как правило, выше, чем недиссоциированных молекул. Кроме того, большинство ионов обладает высокой реакционной способностью, поэтому химические реакции в растворах электролитов протекают с высокими скоростями и химическое равновесие устанавливается быстро.
Химические свойства раствора электролита складываются из свойств образующих его ионов.
Основным фактором, влияющим на смещение равновесия в растворах электролитов, является изменение концентрации ионов, поэтому обменные реакции в растворах идут в сторону малорастворимых веществ или слабых электролитов. Малорастворимые вещества могут выводиться из раствора в виде осадка или в виде газа.
Подавляющее большинство веществ обладает ограниченной растворимостью в воде и других растворителях, поэтому на практике приходится встречаться с системами, в которых в состоянии равновесия находятся осадок и насыщенный раствор электролита. Вследствие динамического характера равновесия скорость процесса растворения будет совпадать со скоростью обратного процесса кристаллизации. Так, для насыщенного раствора электролита АnBm, находящегося в равновесии с его твердой фазой, будет характерен следующий обратный процесс:
Растворение

 АnBm (Т) n×Am+ + mBn-.
АnBm (Т) n×Am+ + mBn-.
Кристаллизация
Этот процесс является гетерогенным, т.е. протекает на поверхности осадка, поэтому константа равновесия процесса будет определяться только произведением активностей ионов в растворе и не зависит от активности твердого компонента:
КР = ПРАnBm = 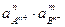 . (3.28)
. (3.28)
Таким образом, произведение активностей ионов электролита, содержащихся в его насыщенном растворе при данной температуре, есть величина постоянная. Эту величину называют произведением растворимости электролита и обозначают ПР.
Произведение растворимости ПР зависит от природы растворенного вещества и растворителя, а также от температуры и не зависит от активностей ионов в растворе.
В настоящее время экспериментальное определение активностей отдельных ионов представляет неразрешимую задачу, поэтому произведение растворимости применяется для малорастворимых электролитов, т.е. таких электролитов, концентрация насыщенных растворов которых незначительна.
Обычно при характеристике малорастворимого электролита указывают или его растворимость, или произведение растворимости при данной температуре, так как между этими величинами существует тесная связь:
ПР = (n×CP× 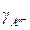 )n×(m×CP×
)n×(m×CP× 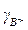 )m, (3.29)
)m, (3.29)
где g - коэффициент активности.
Гидролиз солей
Гидролизом солей называют реакции обмена между водой и растворенными в ней солями. В результате протекания процесса гидролиза в растворе появляется некоторое избыточное количество ионов Н+ или ОН-, сообщающее раствору кислотные и основные свойства. Таким образом, процесс гидролиза соли во многом обратен процессу нейтрализации, т.е. процессу взаимодействия кислот с основаниями. Гидролизу не подвергаются соли, образованные сильными кислотами и основаниями.
Показателем глубины протекания гидролиза является степень гидролиза b, представляющая собой отношение концентрации гидролизованных молекул Сгидр к исходной концентрации растворенных молекул электролита:
b = Сгидр / с. (3.30)
Степень гидролиза, как правило, невелика и увеличивается с возрастанием температуры, поскольку гидролиз – процесс эндотермический.
Константа гидролиза равна отношению ионного произведения воды и константы диссоциации слабого электролита.
Гидролиз соли, образованной сильной кислотой и слабым основанием, приводит к подкислению раствора. При гидролизе соли, образованной слабым основанием и слабой кислотой, образуются как ионы водорода, так и ионы гидроксида. Степень гидролиза и концентрация ионов водорода в этом случае не зависят от исходной концентрации соли:
b = 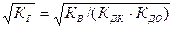 ; [H+] =
; [H+] = 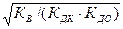 ; рН = 0,5(рК+рКД -рКДО).
; рН = 0,5(рК+рКД -рКДО).
Дата добавления: 2021-11-16; просмотров: 458;











