Электрохимические процессы
Процессы взаимного превращения химической и электрической форм энергии называют электрохимическими процессами. Эти процессы делятся на две группы: процессы превращения химической энергии в электрическую и процессы превращения электрической энергии в химическую.
Простейшая электрохимическая система состоит из двух электродов и ионного проводника между ними, электроды замыкаются металлическим проводником. Ионным проводником (проводником второго рода) служат растворы или расплавы электролитов, а также твердые электролиты. Электродами называют проводники первого рода, имеющие электронную проводимость и находящиеся в контакте с ионным проводником. Электроды, соединенные друг с другом через реостат, измерительный прибор и др., называют внешней цепью электрохимической системы.
К общим закономерностям электрохимических процессов относятся законы Фарадея, термодинамика и кинетика процессов.
Законы Фарадея утверждают следующее:
количество вещества, испытавшего электрохимические превращения, прямо пропорционально количеству прошедшего электричества;
массы прореагировавших на электродах веществ при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов.
Для превращения одного моля вещества на электроде через него проходит 96484 Кл (А×с), и эта величина называется постоянной Фарадея.
В узлах кристаллической решетки металла расположены ионы, находящиеся в равновесии со свободными электронами:
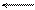
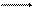 М+×е М+ + е.
М+×е М+ + е.
При погружении металла в раствор начинается сложное взаимодействие металла с компонентами раствора. Наиболее важной является реакция поверхностных ионов металла, находящихся в узлах решетки, с полярными молекулами воды, ориентированными у поверхности электрода. В результате взаимодействия происходит окисление металла, и его гидратированные ионы переходят в раствор, оставляя в металле электроны, заряд которых не скомпенсирован положительно заряженными ионами в металле:
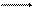 М + mH2O M(H2O)mn+ +ne.
М + mH2O M(H2O)mn+ +ne.
Металл становится заряженным отрицательно, а раствор – положительно. Положительно заряженные ионы из раствора притягиваются к отрицательно заряженной поверхности металла. На границе металл-раствор возникает двойной электрический слой (рис. 4.1).
Рис. 4.1. Двойной электрический слой
на границе раздела металл-раствор
Между металлом и раствором возникает разность потенциалов, которая называется электродным потенциалом или потенциалом электрода.
По мере перехода ионов в раствор растет отрицательный заряд поверхности металла и положительный заряд раствора, что препятствует окислению металла. Наряду с этой реакцией протекает обратная реакция – восстановление ионов металла до атомов
 M(H2O)mn+ +ne М + mH2O.
M(H2O)mn+ +ne М + mH2O.
С увеличением скачка потенциала между электродом и раствором скорость прямой реакции падает, а обратной реакции растет. При некотором значении электродного потенциала скорость прямого процесса будет равна скорости обратного процесса и устанавливается равновесие
 М + mH2O M(H2O)mn+ +ne.
М + mH2O M(H2O)mn+ +ne.
Равновесие имеет динамический характер, процессы при равновесии идут с одинаковой скоростью в прямом и обратном направлениях. Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом. Абсолютные значе-ния электродных потенциалов экспериментально определить невозможно, однако можно определить разность электродных потенциалов, поэтому для характеристики электродных процессов пользуются относительными значениями электродных потенциалов. Для этого находят разность потенциалов измеряемого электрода и электрода, потенциал которого условно принимается равным нулю.
Примером системы, в которой два электрода находятся в растворах собственных ионов, может служить гальванический элемент Даниэля-Якоби. Он состоит из медной пластины, погруженной в раствор ZnSO4 (рис. 4.2), и цинковой пластины, погруженной в раствор CuSO4. Для предотвращения прямого воздействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой.
Рис. 4.2. Схема гальванического
элемента Даниэля-Якоби
На поверхности цинковой пластины возникает двойной электрический слой и устанавливается равновесие
 Zn Zn2+ + 2e.
Zn Zn2+ + 2e.
В результате протекания этого процесса возникает электродный потенциал цинка. На поверхности медной пластины также возникает двойной электрический слой и устанавливается равновесие
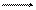
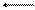 Сu Cu2+ + 2e,
Сu Cu2+ + 2e,
поэтому возникает электродный потенциал меди. Потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, поэтому при замыкании внешней цепи, т.е. при соединении цинка с медью металлическим проводником, электроны будут переходить от цинка к меди. В результате перехода электронов равновесие на цинковом электроде сместится вправо, и в раствор перейдет дополнительное количество ионов цинка. В то же время равновесие на медном электроде сместится влево, и произойдет разряд ионов меди. Данные процессы будут продолжаться до тех пор, пока не выравняются потенциалы электродов (или не растворится весь цинк, или не высадится на медном электроде вся медь).
Итак, при работе элемента Даниэля-Якоби протекают следующие процессы:
реакция окисления цинка
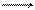 Zn - 2e Zn2+.
Zn - 2e Zn2+.
Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами;
реакция восстановления ионов меди
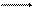 Cu2+ + 2e Сu.
Cu2+ + 2e Сu.
Процессы восстановления в электрохимии получили название катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами;
движение электронов во внешней цепи;
движение ионов в растворе: анионов (SO4) к аноду, катионов (Cu2+, Zn2+) к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента. Суммируя электродные реакции, получаем
Zn + Cu2+ = Сu + Zn2+.
Таким образом, при помощи гальванического элемента совершается электрическая работа за счет энергии химической реакции.
Электрическая работа равна произведению разности потенциалов электродов на количество электричества. Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента. Максимальная электрическая работа гальванического элемента при превращении одного моля вещества равна WМЭ = n×F×EЭ, где EЭ – ЭДС гальванического элемента.
Максимальная полезная работа WМР, которую может совершать система при протекании реакции при постоянном давлении, равна энергии Гиббса реакции WМР = DG. Так как WМР = WМЭ, то
EЭ = [DG / (n×F)]. (4.1)
Уравнение (4.1) показывает связь между химической и электрической энергиями. Энергия Гиббса реакции зависит от активностей а или парциальных давлений P реагентов и продуктов реакции:
DG = DG° - RT×ln 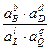 или DG = DG° - RT×ln
или DG = DG° - RT×ln 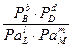 , (4.2)
, (4.2)
где DG° - стандартная энергия Гиббса реакции.
Подставляя (4.2) в (4.1), получим
EЭ = - 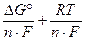 ln
ln 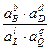 . (4.3)
. (4.3)
При стандартных состояниях
EЭ = (DG° / n×F) = EЭ°, (4.4)
где EЭ° - стандартная ЭДС гальванического элемента.
Из уравнений (4.3) и (4.4) получим уравнение для ЭДС элемента
EЭ = EЭ° + 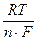 × ln
× ln 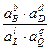 .
.
Прямым измерением разности потенциалов на клеммах гальванического элемента можно получить значение напряжения U, которое не будет равно ЭДС элемента, т.е. U < EЭ. Разница обусловлена омическим падением напряжения внутри элемента при прохождении тока и другими эффектами, поэтому измерение ЭДС проводят компенсационным методом, при котором ток, протекающий через элемент, близок к нулю.
Дата добавления: 2021-11-16; просмотров: 445;











