Электролитическая диссоциация воды. Водородный показатель
Тщательно очищенная вода обладает определенной, хотя и незначительной электрической проводимостью, заметно возрастающей с повышением температуры. Так при 273 К удельная электрическая проводимость воды составляет 1,5×10-8 Ом-1×см-1, при 289 К – 6,2×10-8 Ом-1×см-1.
Наличие электрической проводимости может быть объяснено только тем, что молекулы воды частично распадаются на ионы, т.е. Н2О является слабым электролитом:
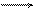
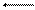
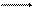
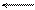 Н2О + Н2О Н3О+ + ОН или в более простой записи Н2О Н+ + ОН-.
Н2О + Н2О Н3О+ + ОН или в более простой записи Н2О Н+ + ОН-.
Этот процесс называется самоионизацией.
Константа диссоциации воды может быть вычислена по уравнению
КД = аН+× аОН / аН2О. (3.26)
При расчетах, связанных с водными растворами электролитов, используют не концентрации, а активность ионов:
аН+×аОН = КВ.
В соответствии с теорией электролитической диссоциации ионы Н+ являются носителями кислотных свойств, а ионы ОН- - носителями основных свойств. Поэтому раствор будет нейтральным, когда аН+ = аОН- = 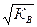 , кислым, когда аН+ > аОН-, и щелочным, когда аН+ < аОН-.
, кислым, когда аН+ > аОН-, и щелочным, когда аН+ < аОН-.
Для характеристики щелочности (кислотности) среды введен специальный параметр – водородный показатель или рН. Водородным показателем или рН называется взятый с обратным знаком десятичный логарифм активности ионов водорода в растворе:
рН = -lgaH. (3.27)
Водородный показатель определяет характер реакции раствора и имеет важное значение для понимания большинства процессов, протекающих в жидкой фазе, так как ионы Н+ и ОН- непосредственно участвуют во многих из этих процессов. Величина рН служит критерием силы кислоты или основания.
Растворы, рН которых относительно мало изменяется при добавлении небольших количеств кислоты или основания, называются буферными. Они обычно содержат слабую кислоту и ее соль или слабое основание и ее соль.
Значение рН можно поддерживать на практически постоянном уровне путем применения буферных смесей.
Дата добавления: 2021-11-16; просмотров: 471;











