Потенциалы механических и газовых электродов
Если потенциал одного из электродов принять равным нулю, то относительный потенциал второго электрода будет равен ЭДС элемента. Таким образом можно определить относительный потенциал любого электрода.
За нуль принят потенциал стандартного водородного электрода. Такой электрод состоит из платинированной платины, контактирующей с газоообразным водородом, находящимся под давлением 100 кПа (S = 1) и раствором, в котором активность ионов Н+ равна единице (рис. 4.3).
Рис. 4.3. Схема водородного электрода
Водородный электрод относится к газовым электродам, т.е. электродам, в которых по крайней мере один из реагентов является газообразным. Так как для протекания электродной реакции необходимы подвод и отвод электронов, то газовые электроды содержат проводники первого рода, которые непосредственно в реакции не участвуют и в ходе реакции не меняются. В качестве проводника первого рода для стандартного водородного электрода служит платина. При контакте платины с молекулярным водородом происходит адсорбция водорода на платине. Адсорбированный водород, взаимодействуя с молекулами воды, переходит в раствор в виде ионов, оставляя в платине электроны. При этом платина заряжается отрицательно, а раствор - положительно. Возникает скачок потенциала между платиной и раствором. Наряду с переходом ионов в раствор идет обратный процесс восстановления ионов Н+ с образованием молекул водорода. Равновесие на водородном электроде можно представить в виде
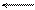
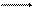 2Н+ +2е Н2.
2Н+ +2е Н2.
Абсолютное значение потенциала водородного электрода неизвестно, но условно считают за нуль потенциал стандартного водородного электрода, т. е. потенциал при 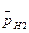 = 100 кПа и аН+ = 1 моль/л.
= 100 кПа и аН+ = 1 моль/л.
Для определения потенциалов по водородной шкале собирают гальванический элемент, одним из электродов которого является измеряемый, а вторым – стандартный водородный электрод (рис. 4.4).
Рис. 4.4. Схема измерения потенциала
электрода
ЭДС элемента и соответственно потенциал по водородной шкале можно определить или экспериментально компенсационным методом, или термодинамически по известным значениям энергии Гиббса токообразующих реакций и по уравнению (4.1) рассчитать ЭДС элемента. Значение ЭДС элемента, в свою очередь, можно рассчитать как разность равновесных потенциалов катода ЕК и анода Еа по водородной шкале.
При погружении металла в раствор собственных ионов устанавливается равновесие
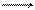
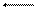 М Мn + nе.
М Мn + nе.
При равновесии скорость растворения металла равна скорости разряда ионов. Потенциал, устанавливающийся на электроде при равновесии, называется равновесным потенциалом металла. Для его измерения нужен гальванический элемент
Н2, Рt½H+½½Mn+½M.
Токообразующей в этом элементе будет реакция
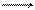 Mn+ + n/2H2 M + nH+.
Mn+ + n/2H2 M + nH+.
Поскольку Е2 = 0, ЭДС элемента равна потенциалу электрода по водородной шкале ЕЭ = 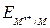 . Так как по условию
. Так как по условию 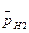 = 1, аН+ = 1, то
= 1, аН+ = 1, то
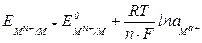 , (4.5)
, (4.5)
где 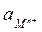 - активность ионов металла.
- активность ионов металла.
Уравнение (4.5) называется уравнением Нернста. Переходя от натуральных логарифмов к десятичным и подставляя в уравнение (4.5) Т = 298К и соответствующие значения R и F, получим
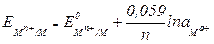 .
.
Для разбавленных растворов, в которых активности мало отличаются от концентраций (а » с), в уравнении (4.5) активность можно заменить концентрацией. Величина 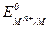 называется стандартным потенциалом металлического электрода, его значение можно получить при
называется стандартным потенциалом металлического электрода, его значение можно получить при 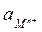 = 1.
= 1.
Стандартные электродные потенциалы металлов указывают на меру окислительно-восстановительной способности металла и его ионов. Чем более отрицательное значение имеет потенциал металла, тем более сильной восстановительной способностью он обладает, и наоборот.
Газовые электроды состоят из металлического проводника, контактирующего одновременно с газом и раствором, содержащим ионы этого газа. Металлический проводник служит для подвода и отвода электронов и, кроме того, является катализатором электродной реакции. Так как в равновесных электродных реакциях газовых электродов участвуют газообразные компоненты, то электродные потенциалы этих электродов зависят от парциальных давлений газов. Равновесие на водородном электроде выражается уравнением
 2Н+ + 2е Н2.
2Н+ + 2е Н2.
Уравнение для расчета потенциала водородного электрона можно получить так же, как выведено уравнение для расчета потенциала металлического электрода. Оно имеет вид
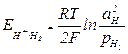 или для 298К
или для 298К 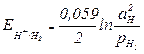 , (4.6)
, (4.6)
где 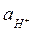 - активность ионов Н+ в электролите;
- активность ионов Н+ в электролите;
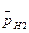 - относительное парциальное давление водорода.
- относительное парциальное давление водорода.
Потенциал водородного электрона принимает более отрицательное значение с увеличением давления водорода и рН.
Аналогично водородному электроду можно создать кислородный электрод.
Дата добавления: 2021-11-16; просмотров: 479;











