Влияние температуры на скорость реакции
Повышение температуры ускоряет большинство химических реакций.
Вант–Гоффом была предложена следующая зависимость для определения скорости реакции в зависимости от температуры:
n2 =n1 g(Т2-Т1)/10, (3.17)
где n2 и n1 – скорости реакций при температурах Т2 и Т1;
g - коэффициент, лежит в пределах 2-4.
Более точное определение зависимости скорости реакции от температуры предложил Аррениус:
к = к0×е(-Еа/RT), (3.18)
где к – константа скорости реакции;
к0 – множитель;
е – основание натурального логарифма;
Еа – постоянная, называемая энергией активации и определяемая природой реакции.
Из соотношения (3.17) можно получить, что
ln (n2/n1) = 
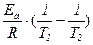 . (3.19)
. (3.19)
Таким образом, скорость реакции (при постоянных концентрациях) возрастает с увеличением температуры по экспоненциальному закону.
Понятие энергия активации основано на следующем. В ходе химической реакции разрушаются одни и создаются другие молекулы и соединения, происходит изменение химических связей. Этот процесс протекает через некоторое переходное состояние, когда старые связи нарушаются, а новые создаются. Для протекания этого переходного процесса требуется дополнительная энергия, называемая энергией активации. Возможность протекания этого процесса определяется энергией молекул.
Экзотермические реакции протекают с меньшей энергией активации, чем эндотермические. Высокая энергия активации, т.е. высокий энергетический барьер, является причиной того, что многие химические реакции при невысо-ких температурах не протекают, хотя и принципиально возможны (DG < 0).
Физическая сущность предэкспоненциального множителя к0 состоит в том, что он учитывает частоту столкновений реагирующих частиц и их полярную ориентацию.
Дата добавления: 2021-11-16; просмотров: 496;











