Валентность атомов. Перекрывание атомных орбиталей.
Основываясь на электронных формулах двух и многоатомных частиц (молекул, ионов), можно определить валентность каждого атома. С точки зрения строения молекул валентность атома в сложной частице - это число общих электронных пар у этого атома в данной частице (по одной на каждую связь), то есть число σ-связей, которые этот атом образовал с другими атомами при формировании сложной частицы.
Например, в молекуле HCl валентность атома водорода H и атома хлора Cl равна 1. В молекуле аммиака NH3 валентность атома азота N равна 3, а в катионе аммония NH4+ валентность атома азота N равна 4 (при валентности каждого из атомов водорода H, равной 1).
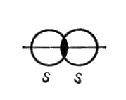
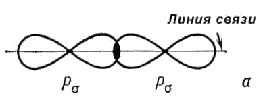
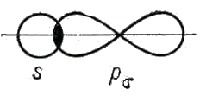
Ковалентная связь между атомами образуется при перекрывании атомных орбиталей, например 1s-орбиталей при образовании связи H−H, 2p-орбиталей при образовании связи F−F, 1s-орбитали атома H и 3p-орбитали атома Cl при образовании связи H−Cl.
При образовании химических связей всегда происходит сдвиг электронной плотности в направлении перекрывания, а это приводит к изменению формы орбиталей по сравнению с их состоянием в свободном атоме.
Полярность молекул
Молекулы, которые образованы атомами одного и того же элемента, как правило, будут неполярными, как неполярны и сами связи в них. Так, молекулы Н2, F2, N2 неполярны.
Молекулы, которые образованы атомами разных элементов, могут быть полярными и неполярными. Это зависит от геометрической формы.
Если форма симметрична, то молекула неполярна (BF3, CH4, CO2, SO3), если асимметрична (из-за наличия неподелённых пар или неспаренных электронов), то молекула полярна (NH3, H2O, SO2, NO2).
При замене одного из боковых атомов в симметричной молекуле на атом другого элемента также происходит искажение геометрической формы и появление полярности, например в хлорпроизводных метана CH3Cl, CH2Cl2 и CHCl3 (молекулы метана CH4 неполярны).
Полярность несимметричной по форме молекулы вытекает из полярности ковалентных связей между атомами элементов с разной электроотрицательностью.
Как отмечалось выше, происходит частичный сдвиг электронной плотности вдоль оси связи к атому более электроотрицательного элемента, например:
| Hδ+ → Clδ− | Bδ+ → Fδ− |
| Cδ− ← Hδ+ | Nδ− ← Hδ+ |
(здесь δ - частичный электрический заряд на атомах).
Чем больше разность электроотрицательностей элементов, тем выше абсолютное значение заряда δ и тем более полярной будет ковалентная связь.
В симметричных по форме молекулах (например, BF3) "центры тяжести" отрицательного (δ−) и положительного (δ+) зарядов совпадают, а в несимметричных молекулах (например, NH3) - не совпадают.
Вследствие этого в несимметричных молекулах образуется электрический диполь - разнесённые на некоторое расстояние в пространстве разноименные заряды, например, в молекуле воды.
Дата добавления: 2017-09-01; просмотров: 1777;











