Молекулы. Химические соединения и реакции
Молекула есть наименьшая структурная единица химического соединения. Молекулы состоят из атомов одинаковых или различных химических элементов. Силы, удерживающие атомы в молекулах, являются проявлением электромагнитного взаимодействия. Существует два типа связей атомов в молекуле: ионная и ковалентная.
Ионная связь заключается в том, что валентные электроны у атомов ряда элементов, слабо связанные с атомом в целом, легко теряются атомом. Атом превращается в положительно заряженный ион. Атомы других элементов, напротив, могут захватывать «чужие» электроны, образуя отрицательно заряженный ион. Между разноименно заряженными ионами действуют кулоновские силы притяжения, которые обеспечивают образование и устойчивость молекул.
Рассмотрим в качестве примера молекулу хлористого натрия NaCL Из периодической системы элементов следует, что атом Na содержит один электрон (подуровень 3s), который слабо связан с атомом в целом. Атом же хлора имеет почти заполненный уровень (для полной застройки ему не хватает одного электрона). Этот недостающий электрон захватывается атомом хлора у атома натрия, в результате чего образуется два иона: Na+ и С1-. За счет ионной связи образуются молекулы-пары «щелочной металл- галоген», «щелочно-земельный металл-оксиген» или «бороген- ннтроген».
Ионная связь характеризуется полным обменом заряда между составляющими молекулу ионами за счет объединения внешних электронных оболочек. Общая молекулярная оболочка подобна оболочке инертных газов. Это довольно сильная связь: например, для NaCl энергия связи, приходящаяся на одну молекулу, равна 7,9 эВ.
Ковалентная связь - это связь атомов посредством общих электронных пар. Она возникает, например, при образовании молекул из одинаковых атомов, например, Н2, О2, N2 и др. Ясно, что в этом случае невозможно выделить положительные и отрицательные ионы. Упрощенно механизм ковалентной связи поясняется схемой (рис. 5.6).
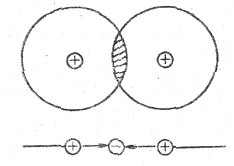
Рис. 5.6.
В промежутке между положительно заряженными ядрами возникает область отрицательного пространственного заряда, обусловленного наличием «общих» электронов. Сила кулоновского притяжения, действующая со стороны отрицательного заряда на положительный, больше, чем сила отталкивания последних, что обеспечивает существование молекул данного типа. При этом происходит лишь частичный обмен зарядами. В каждой ковалентной связи участвуют только два электрона — по одному от каждого атома. Эти электроны наиболее вероятно находятся в области перекрытия их волновых функций.
Ковалентная связь направленная и обладает свойством насыщения. Последнее состоит в том, что у атома может быть столько ковалентных связен, сколько у него валентных электронов. Например, четырехвалентный атом углерода может вступать в ковалентную связь только с четырьмя такими же атомами. Энергия ковалентной связи имеет тот же порядок, что и ионной (~10 эВ/молекул).
И при ионной, и при ковалентной связях при очень большом сближении атомов нарастают силы отталкивания. Рассмотрим в качестве примера молекулу водорода Н2, состоящую из двух протонов (А и В) с зарядами +е и двух электронов (1 и 2) с зарядами -е. Пусть в какой-то момент времени протоны и электроны расположены так, как показано на рис. 5.7.
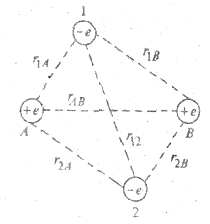 |
Рис. 5.7.
Вспомним, что потенциальная энергия взаимодействия двух зарядов пропорциональна их произведению и обратно пропорциональна расстоянию между ними. В нашем случае
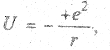
где «+» соответствует отталкиванию, а «-» - притяжению зарядов. Полная потенциальная энергия двух атомов водорода есть сумма потенциальных энергий всех шести попарных независимых взаимодействий

Первый член в этом выражении отражает уменьшение потенциальной энергии, обусловленное притяжением электронов к протонам, второй – увеличение энергии, связанное с отталкиванием попарно электронов и протонов. Характер зависимости потенциальной энергии UΣ от расстояния между атомами rАВ, соответствующий выражению (5.1), приведен на рис. 5.8. Эта зависимость имеет выраженный минимум при rАВ = r0 = 7,4 нм. Это расстояние между атомами и имеет место в молекуле водорода. На рис. 5.8 пунктиром показана потенциальная энергия весьма удаленных друг от друга атомов. При ковалентной связи двух идентичных атомов их электроны как бы делятся поровну и заряды распределены симметрично (как в молекуле водорода Н2).
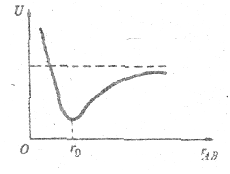
Рис. 5.8.
Если молекула образована из различных атомов на основе ковалентной связи, то заряды в ней (при общей электрической нейтральности молекулы) распределены несимметрично — отрицательный заряд «смещается» к одному из атомов, вследствие чего другой атом приобретает слабый положительный заряд. Такая молекула называется диполем (двухполярной). Количественно диполь характеризуется дипольным моментом 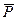 , который равен произведению величины разделенного заряда на расстояние между ними; вектор
, который равен произведению величины разделенного заряда на расстояние между ними; вектор  направлен от положительного заряда к отрицательному (рис. 5.9). Вещества, состоящие из дипольных молекул, называются полярными.
направлен от положительного заряда к отрицательному (рис. 5.9). Вещества, состоящие из дипольных молекул, называются полярными.
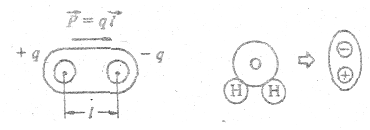
Рис. 5.9 Рис. 5.10
Например, полярными являются молекулы воды (рис. 5.10), а сама вода - полярная жидкость. Диполи в веществе ориентированы хаотично, но под влиянием внешнего электрического поля они ориентируются, образуя в веществе связанный заряд. Это явление называется поляризацией диэлектриков. Электрическое поле связанного заряда ослабляет внешнее поле Е в ε раз (рис. 5.11).
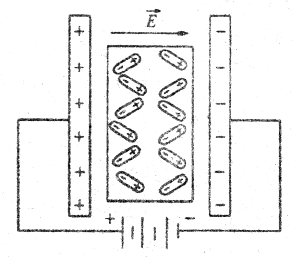
Рис. 5.11.
Величина е называется диэлектрической проницаемостью вещества.
При образовании молекулы энергетические уровни внешних электронов атомов вследствие взаимодействия изменяются; могут также возникать дополнительные уровни. Таким образом, каждый энергетический уровень изолированного атома превращается в ряд близких уровней, вследствие чего спектр излучения и поглощения молекул состоит из очень близких спектральных линий и называется полосатым.
Свойства молекулы определяются не только составом ее (т. е. видом входящих в нее атомов), но и пространственной структурой.
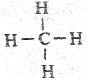
Особый класс молекул составляют молекулы, содержащие атомы углерода. Вещества, состоящие из таких молекул, называются органическими. Число органических веществ (1700 тыс.) значительно превосходит число неорганических (500 тыс.). Большинство из них имеет растительное или животное происхождение. Атомы углерода способны соединяться между собой и с атомами других элементов (чаще всего с водородом, кислородом и азотом), образуя специфические структуры кольца или цепи. При чина этого - повышенная прочность ковалентных связей атомов углерода. Рассмотрим в качестве примера органические вещества - углеводороды. Простейшее углеводородное соединение - метан. Молекула его имеет следующую структуру:
Дата добавления: 2017-11-21; просмотров: 1691;











