Влияние давления на гидратацию белков
Вклад воды в структуру белков
Гидратация очень важна для формирования трехмерной структуры и активности белков [146]. При недостатке воды в белках наблюдается спад активности, тогда как в растворе белки имеют конфирмационную гибкость, которая охватывает широкий диапазон состояний гидратов, а не наблюдаемых в кристалле или в неводных средах. Равновесие между этими состояниями зависит от активности воды в ближайшем окружении, от того, насколько вода свободна для гидратации белка [147].
Свертывание (фолдинг) белков зависит от тех же факторов, которые управляют слипанием гидрофобных поверхностей [97], несовместимость между водой уменьшенной плотности и гидрофобной поверхностью заставляет такие группы формировать гидрофобное ядро. Считается, что биологическая активность белков зависит от формирования двумерной сетки водородных связей, которая охватывает большую часть поверхности белка и объединяет все приповерхностные водные кластеры, образованные водородными связями [148]. Такая водная сеть может передавать информацию вокруг белка и управлять динамикой белка, например, движением его доменов.
Гидрофобные взаимодействия обусловлены уменьшением энтропии при контакте неполярных групп с водой. Рассмотрим молекулу воды рядом с поверхностью, с которой эта молекула не может образовать водородную связь. Несовместимость этой поверхности с водой уменьшенной плотности, которая образуется над такой поверхностью, стимулирует минимизацию площади поверхности приводит к формированию третичной структуры белков. Такой гидрофобный коллапс обязательно сопровождается и управляется формированием вторичной структуры с водородных связей между соответствующими пептидными цепочками параллельно с их десольватации. Движущей силой этого процесса является освобождение и выход воды, затем деградирует другие центры в переполненных внутриклеточных средах и увеличивает суммарную энтропию системы. Подобные факторы работают и при четвертичной организации белков. Таким образом, вода является неотъемлемым участником процесса свертывания белков.
Денатурация
Присутствие воды является критической не только для правильного свертывания белков, но также и для сохранения их структуры. Денатурация (развертывания) белков при нагреве и потеря ими биологической активности связаны с разрывом двумерной сетки из молекул воды, охватывает белок, которая ограничивает или сдерживает вибрационную динамику белка [149]. Можно допустить, что необходимо для разрыва энергия определяет величину барьера U для перехода из нативного в активированное состояние N → 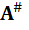 (см. Тему 5). Тогда указанная выше независимость U от размера объекта свидетельствует о существовании критической величины конформационного искажения молекулы белка, достаточного для проникновения воды в глобулы. Показателем прочности сетки водородных связей может служить кислотность среды рH, которая влияет на скорость инактивации микроорганизмов (и денатурации белков) (см. Тему 9). Величина рН снижается с повышением температуры и давления, увеличивает вероятность разрыва.
(см. Тему 5). Тогда указанная выше независимость U от размера объекта свидетельствует о существовании критической величины конформационного искажения молекулы белка, достаточного для проникновения воды в глобулы. Показателем прочности сетки водородных связей может служить кислотность среды рH, которая влияет на скорость инактивации микроорганизмов (и денатурации белков) (см. Тему 9). Величина рН снижается с повышением температуры и давления, увеличивает вероятность разрыва.
Свободная энергия реакции денатурации белка 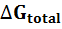 Формируется совместными эффектами сворачивания/разворачивания и сопутствующими изменениями гидратации неполярных и полярных групп белка. Эти взносы в значительной степени компенсируют друг друга, так что свободная энергия стабилизации типичного белка
Формируется совместными эффектами сворачивания/разворачивания и сопутствующими изменениями гидратации неполярных и полярных групп белка. Эти взносы в значительной степени компенсируют друг друга, так что свободная энергия стабилизации типичного белка 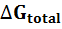 Составляет всего 10-20 ккал/моль, тогда как изменения энтальпии ∆
Составляет всего 10-20 ккал/моль, тогда как изменения энтальпии ∆ 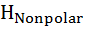 И ∆
И ∆ 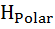
(и умноженной на температуру изменение энтропии T∆ 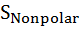 И T∆
И T∆ 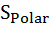 )
)
Могут отличаться более чем на ± 120 ккал/моль [97, 150, 151]. Удивительно, что полученные нами значения активационного барьера U для инактивации микроорганизмов (см. Табл. 7.1, 7.3) попадают в указанный интервал энергий стабилизации 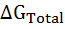 .
.
Таким образом, стабильность белка зависит от баланса между изменениями энтальпии и энтропии. Изменение свободной энергии Гиббса (см. Рис. 10.1) при переходе белка из нативного в денатурированное состояние 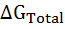 И определяется эффектами развертывания полярных и неполярных групп
И определяется эффектами развертывания полярных и неполярных групп 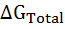 .= ∆
.= ∆ 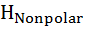 - T∆
- T∆ 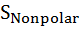 + ∆
+ ∆ 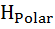 - T∆
- T∆ 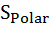 . Там, где ∆
. Там, где ∆ 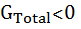 наблюдается тепловая (при Т > Т2 ) и холодовая (при Т <
наблюдается тепловая (при Т > Т2 ) и холодовая (при Т < 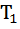 ) денатурация, которая в зависимости от обстоятельств может протекать быстро или непомерно медленно. Область существования нативного состояния
) денатурация, которая в зависимости от обстоятельств может протекать быстро или непомерно медленно. Область существования нативного состояния 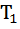 ˂ Т <
˂ Т <  Определяет температурный оптимум активности белка (тема 2).
Определяет температурный оптимум активности белка (тема 2).
Основываясь на указанных выше фактах, проиллюстрируем зависимость стабильности белка от давления. Подытоживая характерные изменения вкладов от развертывания полярных и неполярных групп, получаем свободную энергию Гиббса (см. Рис. 10.2) для перехода белка из нативного в денатурированное состояние ∆ 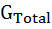 = ∆
= ∆ 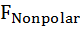 + ∆
+ ∆ 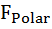 + P∆
+ P∆ 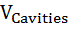 +P∆
+P∆ 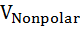 + P∆
+ P∆ 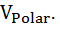 Область давлений выше некоторого критического давления Р > РС соответствует денатурированном состояния белка. Скорость денатурации при попадании системы в эту область определяется величиной активационного барьера, слагаемое U в котором одинаковый для термо- и бароденатурации и связан с разрывом двухмерной сетки водородных связей.
Область давлений выше некоторого критического давления Р > РС соответствует денатурированном состояния белка. Скорость денатурации при попадании системы в эту область определяется величиной активационного барьера, слагаемое U в котором одинаковый для термо- и бароденатурации и связан с разрывом двухмерной сетки водородных связей.
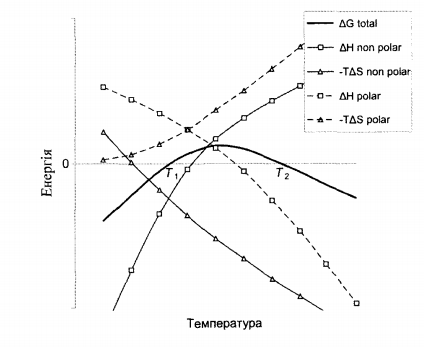
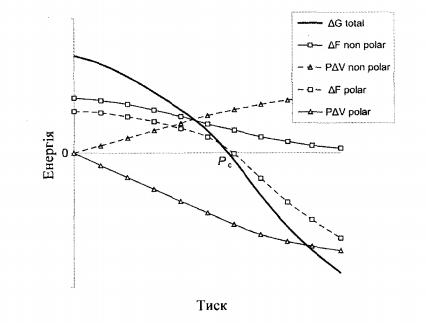
Рис.10.2 - Иллюстрация зависимости свободной энергии денатурации от давления [4]
Влияние давления на скорость денатурации определяется суммарным изменением объема при заполнении водой внутренних полостей белка и гидратации развернутых полярных и неполярных групп ∆V = ∆ 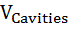 +∆
+∆ 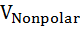 + ∆
+ ∆ 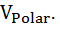 Область существования нативного состояния
Область существования нативного состояния
Дата добавления: 2021-09-25; просмотров: 604;











