Соединения водорода
Если учесть органические вещества, то следует признать, что водород - элемент, образующий наибольшее число соединений. Важнейшими неорганическими соединениями водорода являются гидриды и бинарные соединения водорода в степени окисления +1. Последние также часто называют гидридами, что не совсем корректно, ибо гидриды - это бинарные соединения водорода в степени окисления -1. "Классические гидриды" могут образовывать только те элементы, электроотрицательность у которых значительно меньше, чем у водорода. Это щелочные и щелочноземельные металлы, а также магний и бериллий. Они образуют типичные солеподобные гидриды, при электролизе расплавов которых водород выделяется на аноде:
2H- - 2e- ® H20
При взаимодействии гидридов данного типа с водой также выделяется водород:
NaH-1 + H2+1O = NaOH + H20
Элементы, электроотрицательность которых незначительно отличается от водорода, образуют ковалентные гидриды (B2H6, SiH4). Известно небольшое число комплексных гидридов, например, Li[AlH4], Na[BH4], которые широко применяются в органическом синтезе в качестве восстановителей.
Из бинарных соединений водорода в степени окисления +1 в данном разделе будет рассмотрен оксид водорода (вода) и его пероксид (перекись водорода).
Химически чистая вода представляет собой бесцветную жидкость без вкуса и запаха. Молекула воды - Н2О - имеет угловое строение. Образование молекулы воды происходит с участием sp3-гибридных орбиталей атома кислорода, две из которых заняты неподеленными электронными парами и поэтому вклада в геометрию молекулы не вносят. Перекрывание одноэлектронных облаков двух гибридных орбиталей кислорода и 1s-орбиталей двух атомов водорода приводит к образованию уголковой молекулы. Отталкивающие действие двух неподеленных пар электронов уменьшает валентный угол HOH до 104,5° (см. стр. 19).
В кристаллическом состоянии молекула воды, окруженная четырьмя соседями, образует с ними очень прочные водородные связи, вследствие чего вода обладает аномально высокой температурой кристаллизации (0 °) и кипения (100 °С). Согласно клатратной теории в жидкой воде существуют микроскопические фрагменты кристаллической структуры льда - клатраты, находящиеся в равновесии с жидкой фазой.
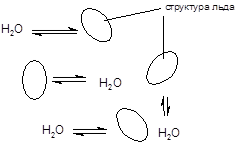
За счет образования прочных водородных связей, а также координационных соединений, вода является хорошим растворителем для многих типов органических и неорганических соединений, частицы которых существуют в растворах в виде аддуктов с молекулами воды - гидратов. При выделении из водных растворов многие вещества кристаллизуются в виде гидратов, образуя кристаллогидраты. Можно выделить три типа кристаллогидратов, отличающихся характером связывания воды:
1. Клатраты - имеющие кристаллическую структуру льда, полости которой заняты частицами вещества. Такое строение имеют кристаллогидраты солей щелочных металлов, содержащие большое количество воды, например, Na2SO4×10H2O, а также кристаллогидраты, образуемые галогенами и инертными газами - Cl2×8H2O, или Ar 6H2O.
2. Аквакомплексы, содержащие воду, координированную катионом металла, чаще всего переходного, например, CoCl2×6H2O, точнее [Co(OH2)6]Cl2.
3. Кристаллогидраты, содержащие воду, связанную с частицами вещества водородными связями. Часто этот тип связывания воды реализуется в кристаллогидратах органических веществ.
С химической точки зрения вода довольно реакционноспособное соединение, вступающее во взаимодействие с различными простыми и сложными веществами, в том числе с органическими соединениями.
Кроме оксида водорода хорошо изучен его аналог - оксид дейтерия - D2O, более известный под названием "тяжелая вода". Тяжелая вода широко применяется в атомной энергетике как замедлитель нейтронов. Реакции с участием тяжелой воды идут медленней, а температура ее кипения (101,4 °С) несколько выше по сравнению с H2O, поэтому при проведении электролиза или дистилляции большого количества воды тяжелая вода накапливается в остатке.
Пероксид водорода (перекись) - Н2О2 - бесцветная сиропообразная жидкость (d = 1,45 г/см3), неустойчивая в чистом виде, но устойчивая в водных растворах до 30% концентрации. Распад пероксида водорода катализируется соединениями тяжелых металлов, например, MnO2.
2Н2О2 = 2Н2О + О2
Получают пероксид водорода электролизом водных растворов серной кислоты или гидросульфата аммония. При этом на аноде образуется пероксосерная кислота, гидролиз которой приводит к образованию пероксида водорода:
2HSO4- - 2e- ® H2S2O8
H2S2O8 + 2H2O = 2H2SO4 + H2O2
Вследствие промежуточной степени окисления кислорода (-1), пероксид водорода, в зависимости от условий проведения реакции, может быть как окислителем, так и восстановителем. В кислой среде H2O2 довольно сильный окислитель:
H2O2 + 2H+ + 2e- ® 2H2O; E0 = 1,78 В
В то же время пероксид водорода окисляется более сильными окислителями, например, перманганатом калия:
2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + 5O2 + K2SO4 + 8H2O
Водные растворы пероксида водорода (в основном 3%) применяются для отбелки тканей и меха, дезинфекции, консервации, протравливания семян. Важную роль пероксид водорода играет в процессах самоочищения природных водоемов, в которых он содержится в ничтожной концентрации (порядка 3×10-5 моль/л), но тем не менее, эффективно окисляет биологические загрязнения.
Литература: [1] с. 330 - 338, [2] с. 411 - 415, [3] с. 262 - 270
Дата добавления: 2017-10-04; просмотров: 1974;











