Лекция № 18. Водород
Водород расположен в первом периоде периодической системы химических элементов (элемент № 1), представлен в природе тремя изотопами: протий 1H, дейтерий 2H (D), тритий 3H (T). Протий и дейтерий стабильные изотопы (содержание дейтерия в природном водороде составляет 0,015%), тритий радиоактивен (период полураспада 12,26 года), образуется в верхних слоях атмосферы под действием космических лучей и содержится в природном водороде в исчезающе малом количестве.
Атом водорода содержит на внешнем и единственном энергетическом уровне один электрон (1s1) и является электронным аналогом щелочных металлов. В то же время, до завершения валентного уровня атому водорода недостает одного электрона, что роднит его с галогенами. По этой причине водород часто помещают как в первую, так и в седьмую группу периодической системы.
Водород, наряду с гелием, самый распространенный элемент Вселенной, он составляет до половины массы звезд и основную массу межзвездной материи. Содержание водорода в земной коре (кларк) составляет 3 мол.%. Водород - элемент-органоген и входит в состав органических соединений.
Простое вещество водород - H2 - бесцветный газ, не имеющий вкуса и запаха, не обладающий физиологическим действием, т.пл. -259,2 °С (14 К), т.кип. -252,8 °С (20 К). Водород - самый легкий из газов (в 14,5 раз легче воздуха), с высокой скоростью диффузии, легко проникает через разнообразные перегородки. Плохо растворим в воде, но хорошо растворим в некоторых металлах (Ni, Pt, Pd).
Получение водорода. В промышленности водород получают конверсией метана или угля водяным паром, а также неполным окислением метана:
t
CH4 + H2O = CO + 3H2
t
C + H2O = CO + H2
t
2CH4 + O2 = 2CO + 4H2
Лабораторные методы получения водорода:
1. Действие кислот на металлы (обычно действуют на цинк соляной кислотой в аппарате Киппа).
Zn + 2HCl = ZnCl2 + H2
2. Действие щелочей на алюминий.
2Al + 6KOH + 6H2O = 2K3[Al(OH)6] + 3H2
3. Электролиз водных растворов щелочей на никелевых электродах.
эл.ток
2H2O = 2H2 + O2
4. Взаимодействие гидрида кальция с водой.
CaH2 + 2H2O = Ca(OH)2 + 2H2
Химические свойства. Особенности строения электронной оболочки атома водорода обуславливают его способность к присоединению одного электрона. Поэтому водород может выступать как окислитель, образуя соединения в степени окисления -1. В то же время невысокая электроотрицательность водорода (2,2 по Л. Полингу) способствует потере одного электрона и образованию соединений в степени окисления +1.
+e- -e-
H- ¾ H ¾® H+
Довольно высокая энергия диссоциации молекулы Н2(435 кДж/моль) обуславливает инертность водорода в обычных условиях. При комнатной температуре водород реагирует только со фтором:
H2 + F2 = 2HF
При нагревании водород реагирует со многими неметаллами (Cl2, Br2, O2, N2, S, C), проявляя при этом свойства восстановителя. Взаимодействие с хлором и кислородом инициируется ультрафиолетовым облучением и протекает по радикальному механизму. При этом реакция с хлором протекает по неразветвленному цепному механизму и включает ряд стадий:
1. Инициация цепи (фотохимическая диссоциация):
Cl2 + hn ® 2Cl×
2. Рост (развитие) цепи:
Cl× + H2 ® HCl + H×
H× + Cl2 ® HCl + Cl×
3. Обрыв цепи:
H× + Cl× ® HCl
Реакция водорода с кислородом идет по механизму цепной разветвленной реакции, включая следующие стадии:
1. Инициация цепи: H2 + O2 ® ×OH + HO×
2. Рост цепи: HO× + H2 ® H2O + H×
3. Разветвление цепи: H× + O2 ® ×OH + ×O×
×O× + H2 ® ×OH + ×H
4. Обрыв цепи: HO× + ×H ® H2O
При нагревании водород реагирует со щелочными и щелочноземельными металлами, образуя соответствующие гидриды - бинарные соединения водорода в степени окисления -1.
t
2Na + H2 = 2NaH-1
гидрид натрия
При повышенных температурах водород восстанавливает металлы из их оксидов и галогенидов:
t t
CuO + H2 = Cu + H2O; CuCl2 + H2 = Cu + 2HCl
Восстановительные свойства водород способен проявлять также и по отношению к оксидам неметаллов и органическим соединениям, например,
t
N2O + H2 = N2 + H2O
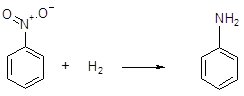
нитробензол анилин
Большое значение для синтеза органических соединений имеет реакция каталитического присоединения водорода по кратным связям углерод - углерод (гидрогенизация или гидрирование):
t
C2H4 + H2 ® C2H6
Pd
Дата добавления: 2017-10-04; просмотров: 1903;











