Электролитов. Произведение растворимости
Буферными называются растворы, незначительно изменяющие рН при добавлении небольших количеств сильной кислоты или сильного основания, а также при разбавлении. Чаще всего буферный раствор содержит два компонента, один из которых способен связывать катионы водорода, а другой - гидроксид-анионы. Например, механизм действия ацетатного буфера (CH3COOH + CH3COONa) может быть описан следующим образом. При добавлении небольшого количества щелочи последняя нейтрализуется кислотой по уравнению:
CH3COOH + NaOH ® CH3COONa + H2O
Добавление сильных кислот приводит к вытеснению уксусной кислоты из её соли. Так как уксусная кислота является кислотой слабой, рН раствора практически не изменяется:
CH3COONa + HCl ® CH3COOH + NaCl
Количество кислоты или основания, необходимое для изменения pH одного литра буферного раствора на единицу, называется его буферной емкостью.
Буферным действием могут обладать также растворы амфотерных веществ (амфолитов), содержащих два вида функциональных групп, способные связывать катионы водорода и реагирующие с гидроксид-анионами. К соединениям такого рода относятся аминокислоты, например, глицин (аминоуксусная кислота).
H2N-CH2-COOH + HCl ® Cl-H3N+-CH2-COOH
H2N-CH2-COOH + NaOH ® H2N-CH2-COOH + H2O
Большой буферной емкостью обладают белки и полипептиды, содержащие свободные амино- и карбоксильные группы. Буферные системы играют очень важную роль в биохимии живых организмов, поскольку ферменты очень чувствительны к изменению кислотности среды.
Рассмотрим примеры расчета pH кислотного и основного буферного раствора.
Пример № 1. Ацетатный буфер (0,01М CH3COOH + 0,01 М CH3COONa). Кислотность данного раствора обусловлена диссоциацией уксусной кислоты
CH3COOH  CH3COO- + H+
CH3COO- + H+
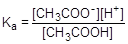 = 1,75×10-5
= 1,75×10-5
Наличие в растворе ацетата натрия практически полностью подавляет данный процесс в соответствие с принципом Ле Шателье. В свою очередь, присутствие в растворе уксусной кислоты подавляет гидролиз ацетат-аниона, поэтому в первом приближении
[CH3COOH] = Ск-ты; [CH3COO-] = Ссоли
Подставим данные величины в константу диссоциации кислоты и преобразуем полученное выражение:
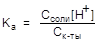 ; отсюда
; отсюда 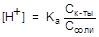 ;
;
pH = -lg[H+] = pK + lg 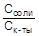 = 4,75
= 4,75
Поскольку в полученную формулу входит отношение концентраций компонентов раствора, его pH не должен изменяться при разбавлении.
Пример № 2. Аммиачный буфер (0,01М NH3×H2O + 0,01М NH4Cl). Кислотность, точнее основность, данного раствора определяется ионизацией аммиака.
NH3×H2O  NH4+ + OH-
NH4+ + OH-
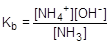 = 1,8×10-5
= 1,8×10-5
Так как [NH4+] = Cсоли, а [NH3×H2O] = Сосн,, то
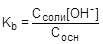 , отсюда
, отсюда 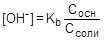 ;
;
pOH = - lg[OH-] = pKb - lg(Сосн/Cсоли)
pH = 14 - pKb + lgСосн - lgCсоли = 14 - 4,76 = 9,24
Равновесия в растворах малорастворимых электролитов. В растворах малорастворимых сильных электролитов, к которым относятся большинство малорастворимых солей, устанавливается равновесие между твердой фазой и раствором (гетерогенное равновесие). Рассмотрим особенности данного равновесия на примере сульфата свинца.
PbSO4(к)  Pb2+(р) + SO42-(р)
Pb2+(р) + SO42-(р)
Константа этого равновесия называется произведением растворимости и обозначается символом ПР. Вещества, образующие твердые фазы, не входят в уравнение закона действия масс, поэтому выражение для константы будет иметь следующий вид:
ПР = [Pb2+][SO42-]
Таким образом, в насыщенном растворе малорастворимого электролита произведение концентраций ионов, отщепляемых электролитом, является постоянной величиной.
Произведение растворимости является одной из фундаментальных характеристик малорастворимого вещества, поэтому эти величины сведены в специальные таблицы, т.е. являются справочными. Зная ПРмалорастворимого электролита, можно решить ряд задач, имеющих прикладное значение. Например, можно определить будет ли происходить образование осадка при смешивании реагентов. Для этой цели служит правило произведения растворимости: осадок образуется в том случае, когда произведение концентрации ионов малорастворимого электролита больше его произведения растворимости. По величине ПР можно рассчитать растворимость вещества в воде и водных растворах электролитов. Например, для сульфата свинца
ПР = [Pb2+][SO42-] = 1,6×10-8
Из уравнения процесса растворения видно, что [Pb2+] = [SO42-] = s. Отсюда следует, что
ПР = s2, а 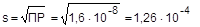 (моль/л)
(моль/л)
Введение в раствор других электролитов изменяет растворимость сульфата свинца. Например, в 0,01 М растворе сульфата натрия [SO42-] = 0,01, тогда
s = [Pb2+] = 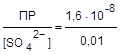 = 1,6×10-6 (моль/л).
= 1,6×10-6 (моль/л).
Аналогично, в 0,001М растворе нитрата свинца [Pb2+] = 0,001, а
s = [SO42-] = 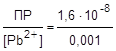 = 1,6×10-5 (моль/л).
= 1,6×10-5 (моль/л).
Литература: [1] с. 241 - 242; [2] с. 298 - 299, 302 - 304
Дата добавления: 2017-10-04; просмотров: 2046;











