Рост кислотности среды под давлением как фактор инактивации микроорганизмов
Рассмотрим возможную роль изменения кислотности в механизме инактивации микроорганизмов под давлением. С этой целью перечислим факторы, которые обусловливают равновесную кислотность водных растворов, проанализируем данные о влиянии кислотности среды на инактивацию микроорганизмов, сопоставим полученные в работе данные о связи критического давления и кислотности окружения в процессах инактивации некоторых микроорганизмов, экспериментально проверим влияние изменения кислотности на деградацию витамина С под давлением, обсудим физические причины изменения кислотности под давлением и, наконец, сделаем выводы о посредственном инактивационном влиянии на микроорганизмы повышенной температуры и давления из-за повышения кислотности окружения [6].
Ионизация воды
Молекулы воды ионизируются спонтанно в результате флуктуаций электрического поля, вызванные тепловыми колебаниями соседних диполей, и благоприятной совокупности величин водородных связей с ближайшим окружением. Ионы могут разойтись благодаря механизмам ионного транспорта, или повторно соединиться в пределах нескольких фемтосекунд. Разделившись, ионы ( 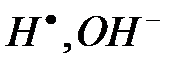 ) гидратируются независимо и продолжают свое уединенное существования примерно 70 мкс (время жизни зависит от температуры). Эти процессы определяют величину константы ионизации или ионного образования
) гидратируются независимо и продолжают свое уединенное существования примерно 70 мкс (время жизни зависит от температуры). Эти процессы определяют величину константы ионизации или ионного образования 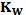 для воды [136]:
для воды [136]:
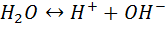
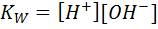
(9.1)
Где 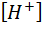 и
и 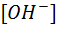 - равновесные концентрации ионов водорода и гидроксида, а точнее - их всевозможных гидратов, в форме которых они существуют в жидкой воде.
- равновесные концентрации ионов водорода и гидроксида, а точнее - их всевозможных гидратов, в форме которых они существуют в жидкой воде.
Ионы водорода производятся в уже гидратированной форме как ионы гидрониума Н3О+. Все три водородные атомы в ионах гидрониума удерживаются сильными ковалентными связями и эквивалентны. Поэтому уравнение (9.1) точнее будет записать:
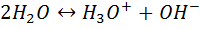
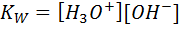 (9.2)
(9.2)
Расчеты аb initio показывают [137], что ион гидрониума Н3О+ в воде имеет симметрию 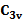 , длину связи О-Н 0,961 А, угол Н-О-Н 114,7 °. Ион гидроксида имеет примерно ту же длину связи О-Н 0,958.A.
, длину связи О-Н 0,961 А, угол Н-О-Н 114,7 °. Ион гидроксида имеет примерно ту же длину связи О-Н 0,958.A.
Концентрации [Н3] и [OН-] в воде одинаковые и равны квадратному корню из константы ионизации 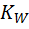 (9.2). Это полные концентрации всевозможных гидратированных кластеров. Концентрация ионов гидрониума (кислотность раствора) в основном определяется через « водородный показатель » рН
(9.2). Это полные концентрации всевозможных гидратированных кластеров. Концентрация ионов гидрониума (кислотность раствора) в основном определяется через « водородный показатель » рН
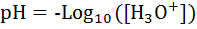
(9.3)
Таким образом,
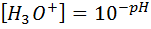
(9.4)
Значение равновесной константы ионизации 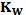 определяется условиями термодинамического равновесия между нейтральными молекулами воды, которые являются динамично связанными трехмерной сеткой водородных связей [142] и примесями различным образом гидратированных заряженных кластеров гидрониума и гидроксида.
определяется условиями термодинамического равновесия между нейтральными молекулами воды, которые являются динамично связанными трехмерной сеткой водородных связей [142] и примесями различным образом гидратированных заряженных кластеров гидрониума и гидроксида.
Хотя степень ионизации очень мала ([ 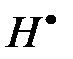 ]/[Н20] = 2,8 10-9 при 37°С), эта ионизация и незначительные изменения концентрации водородных ионов являются критическими для многих жизненных процессов. Протонный транспорт в воде осуществляется аномально быстро путем туннелирования протонов от одной молекулы воды к другой через водородную связь по механизму Гротуса [138], при котором молекулы обмениваются зарядом через переориентацию водородных связей. Вероятно, параметр рН влияет на среднюю эффективность таких процессов, характеризуя способность окружения передавать биологические сигналы, в свою очередь определяет условия функционирования белков.
]/[Н20] = 2,8 10-9 при 37°С), эта ионизация и незначительные изменения концентрации водородных ионов являются критическими для многих жизненных процессов. Протонный транспорт в воде осуществляется аномально быстро путем туннелирования протонов от одной молекулы воды к другой через водородную связь по механизму Гротуса [138], при котором молекулы обмениваются зарядом через переориентацию водородных связей. Вероятно, параметр рН влияет на среднюю эффективность таких процессов, характеризуя способность окружения передавать биологические сигналы, в свою очередь определяет условия функционирования белков.
Дата добавления: 2021-09-25; просмотров: 583;











