ПРИМЕНЕНИЕ КОНСТАНТЫ РАВНОВЕСИЯ
Знание константы равновесия может помочь решить следующие проблемы:
· определить, какая реакция (прямая или обратная) будет протекать самопроизвольно в системе до достижения ею равновесия;
· рассчитать равновесные и исходные концентрации реагентов и продуктов реакции.
Для решения первой задачи в выражение для константы равновесия надо подставить реальные концентрации веществ в данный момент времени в неравновесной смеси и рассчитать величину, обозначаемую Пс, — стехиометрическое соотношение реальных или текущих концентраций.
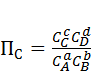 (6)
(6)
По мере приближения системы к состоянию равновесия величина ПC стремится к КС и в момент достижения равновесия становится ей равной.
Если соотношение реальных концентраций (ПC) меньше КC,это означает, что числитель в уравнении (6) должен увеличиваться за счет уменьшения знаменателя, и самопроизвольно будет протекать прямая реакция.
Если же значение ПC больше КC, это означает, что знаменатель в уравнении (6) должен увеличиваться за счет уменьшения числителя, и самопроизвольно будет протекать обратная реакция.
Таким образом, при простом сопоставлении величин ПC и КC можно предсказать, в каком направлении осуществляется реакция при определенных условиях, а именно:
а) ПC меньше КC — протекает прямая реакция;
б) ПC больше КC — протекает обратная реакция;
в) ПC равно КC — реакция находится в состоянии равновесия.
Для нахождения равновесных концентраций рассчитаем величину ПC и сравним ее с известным значением КC.
Если ПC < КC, следует записать выражение для КC с учетом стехиометрии и того, что концентрации реагентов будут уменьшаться на какое-то число (пх), а продуктов — увеличиваться.
Решение уравнения относительно х позволит найти равновесные концентрации.
аА + bВ D сС + dD
Исходная концентрация СА СВ СС CD
Изменение концентрации -ax -bх +сх +dx
Концентрация при равновесии СА – ах СВ – bx СС + сх CD + dx
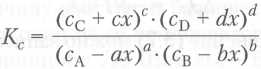
Если ПС > КС, следует записать выражение для константы равновесия КС с учетом того, что концентрации продуктов будут уменьшаться на некоторое число (пх), а концентрации реагентов — увеличиваться в соответствии со стехиометрическими коэффициентами в уравнении реакции. Решение уравнения относительно х позволит рассчитать равновесные концентрации.
аА + bВ D сС + dD
Исходная концентрация СА СВ СС CD
Изменение концентрации +ax +bх -сх -dx
Концентрация при равновесии СА + ах СВ + bx СС – сх CD – dx
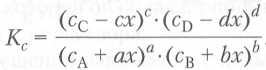
Пример. Исходные концентрации СО, Н2O, СO2 и Н2 в газовой смеси составляли 0,8, 0,8, 1,4 и 1,0 моль/л соответственно. Определите направление процесса и рассчитайте равновесные концентрации веществ при некоторой температуре, если КС при этом равна единице.
СО(г) + Н2О(г) D СО2(г) + Н2(г)
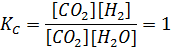
Прежде всего необходимо определить направление, в котором будет протекать процесс. Для этого необходимо рассчитать ПС — величину, получаемую при подстановке реальных концентраций участников реакции в выражение константы равновесия
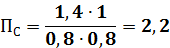
В нашем случае ПС = 2,2, т.е. ПС > КС, поэтому для достижения химического равновесия часть продуктов реакции должна превратиться в исходные вещества. Если концентрация каждого из продуктов реакции при этом уменьшилась на х моль/л, то согласно стехиометрическим коэффициентам концентрации исходных веществ должны увеличиться на ту же величину. Тогда
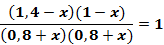
откуда х = 0,06.
Равновесные концентрации СО, Н2O, СO2 и Н2 будут равны 0,86, 0,86, 1,34 и 0,94моль/л соответственно.
Дата добавления: 2021-09-07; просмотров: 642;











