КОНСТАНТА ХИМИЧЕСКОГО РАВНОВЕСИЯ
ОСНОВЫ ХИМИЧЕСКОГО РАВНОВЕСИЯ
В результате изучения содержания этой главы студент должен:
Знать
• сущность явлений обратимых и необратимых химических реакций, химического равновесия, определение константы равновесия, зависимость положения равновесия и константы равновесия от внешних факторов, закон действующих масс;
• принцип Ле Шателье — Брауна;
• связь энергии Гиббса и константы равновесия;
Уметь
• записывать выражение для константы равновесия и рассчитывать ее значение;
• определять направление протекания самопроизвольного процесса;
• рассчитывать исходные и равновесные концентрации веществ;
• определять значение энергии Гибсса по значению константы равновесия при данной температуре;
Владеть
• методикой расчета значения константы равновесия;
• способами вычисления исходных и равновесных концентраций реагентов и продуктов реакции;
• техникой проведения химических экспериментов (пробирочных реакций);
• навыками работы с химическим оборудованием и реактивами.
Все реакции подразделяются на практически необратимые (→), протекающие только в одном направлении, и обратимые (↔), протекающие как в прямом, так и в обратном направлении в одних и тех же условиях. В последних в реакционной смеси одновременно присутствуют и продукты, и реагенты.
Прямая и обратная реакции в обратимых процессах могут протекать неограниченно долго. Однако в определенный момент времени все видимые изменения прекращаются, при этом скорость прямой реакции становится равной скорости обратной (обе скорости измерены по одному и тому же веществу). Такое состояние называется динамически равновесным, или просто равновесным.
Отметим, что система будет находиться в состоянии равновесия до тех пор, пока остается изолированной.
Основной характеристикой любого химического равновесия является константа химического равновесия, которая в первую очередь зависит от природы взаимодействующих веществ.
КОНСТАНТА ХИМИЧЕСКОГО РАВНОВЕСИЯ
Запишем некоторую обратимую реакцию в общем виде
аА + ЬВ +D сС + dD
Концентрации веществ в состоянии равновесия называются равновесными и обозначаются формулой вещества в квадратных скобках [X]. Константа равновесия (Кс), выраженная через концентрации (закон действующих масс), равна
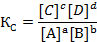
В числителе находится произведение равновесных концентраций продуктов реакции в степени, соответствующей стехиометрическим коэффициентам, в знаменателе – произведение равновесных концентраций исходных веществ в соответствующей степени.
Выражение справедливо для идеальных растворов, в которых не учитываются межмолекулярные и межионные взаимодействия. Для точных расчетов в реальных растворах необходимо вместо концентраций использовать значения активностей.
КС не зависит от концентраций реагентов и продуктов, но зависит от температуры.
Для реакций с участием газов константа равновесия (Кр) может быть выражена через парциальные давления газов.
Парциальное давление — давление, которое оказывало бы имеющееся в смеси количество данного газа, если бы оно одно занимало при той же температуре весь объем, занимаемый смесью.
Концентрацию газа можно выразить через его давление на основании уравнения состояния идеального газа (уравнение Менделеева — Клапейрона):
pV = nRT, (1)
где р и V — давление и объем соответственно; п — количество вещества; R - универсальная газовая постоянная (постоянная Ридберга, 8,31 Дж/(моль∙К)); Т - абсолютная температура,К.
Уравнение (1) запишем в виде
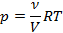
Заменив ν/V на СM (молярную концентрацию, моль/л), получим
р = CM RT. (2)
Константа равновесия, выраженная через парциальные давления, будет
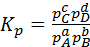 (3)
(3)
Выражение справедливо для идеальных газов, в которых не учитываются межмолекулярные взаимодействия. Для точных расчетов в реальных газах необходимо вместо концентраций использовать значения фугитивностей, учитывающих эти взаимодействия.
После замены в уравнении (3) парциальных давлений на выражения для них из уравнения (2) получим
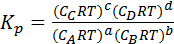 (4)
(4)
Изменение количества вещества в рассматриваемой реакции ∆ν = (с + d – а – b), следовательно
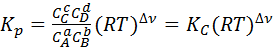 (5)
(5)
Уравнение (5) выражает зависимость между величинами Кр и Кс.
Для гомогенного равновесия (все вещества находятся либо в газовой, либо в однородной жидкой фазе) в выражении для константы участвуют концентрации всех веществ.
Для равновесия в разбавленном растворе концентрация растворителя, участвующего в равновесии, обычно считается постоянной и включается в значение Кс.
Например, для равновесия в водном растворе
NH3 + Н2O D NH4+ + ОН-
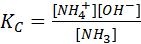
Для гетерогенного равновесия в выражении для константы участвуют только концентрации веществ, находящихся в однородной (газовой или жидкой) среде.
Рассмотрим реакцию термического разложения карбоната кальция на оксид кальция и оксид углерода (IV) в изолированной системе
СаСО3 D СаО(тв) + СO2(г)
Запишем выражение для константы равновесия в каноническом виде:
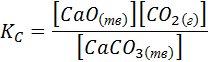
Гетерогенная реакция протекает на границе раздела фаз. В этом случае концентрацию индивидуального вещества на поверхности конденсированной фазы (твердой или жидкой) можно считать постоянной, т.е. это вещество не влияет на положение химического равновесия.
Это означает, что концентрации этих веществ остаются неизменными, следовательно, они могут быть включены в константу

Заменив выражение в левой части уравнения на КC, получим новое уравнение
КC = [СO2(г)].
Физический смысл выражения константы равновесия в этом случае заключается в неизменности концентрации СO2 над твердыми реагентом и продуктом реакции при заданной температуре.
Заменив концентрацию газа на его парциальное давление (Па, атм), получим
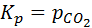
Таким образом, в случае гетерогенных равновесий газ — твердое тело или газ — жидкость в выражение константы равновесия вводятся только концентрации или парциальные давления газов. В случае гетерогенных равновесий раствор — твердое тело в выражение константы равновесия вводятся только концентрации растворенных веществ.
Дата добавления: 2021-09-07; просмотров: 409;











