СМЕЩЕНИЕ ПОЛОЖЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
Равновесие, установившееся в химической системе, может быть смещено под воздействием различных внешних факторов.
Общим принципом, определяющим результат внешнего воздействия и любую равновесную систему (и не только химическую), является принцип адаптивных перестроек, в химии называемый принципом Ле Шателье—Брауна.
Если на систему, находящуюся в состоянии равновесия, оказывается какое-либо внешнее воздействие, то равновесие смещается таким образом, чтобы уменьшить это воздействие.
Рассмотрим эти факторы:
1. Концентрация.
Изменение концентраций реагентов или продуктов реакции не влияет на величину константы равновесия. Однако если к равновесной системе добавить один из ее компонентов (т.е. увеличить его концентрацию), согласно принципу Ле Шателье—Брауна произойдет сдвиг равновесия в сторону уменьшения количества вещества добавленного компонента.
Смещение равновесия можно провести несколькими способами:
· при выведении из равновесной системы одного из ее компонентов смещение равновесия приводит к его образованию.
Таким образом, непрерывно выводя продукты из реакционной смеси, можно постоянно удерживать систему в неравновесном (несбалансированном) состоянии. Это позволяет, вводя все новые количества реагентов, получать непрерывно соответствующие продукты. Предложенный способ проведения реакции осуществим, если один из продуктов реакции может выделяться в виде газа, конденсироваться или вымораживаться из газовой фазы в виде жидкости или твердого вещества, вымываться из газовой смеси потоком жидкости, в которой он обладает повышенной растворимостью, либо осаждаться из газа или раствора.
· увеличение концентрации другого, менее ценного исходного вещества с целью более полного использования ценного исходного соединения.
В качестве примера рассмотрим реакцию, приводящую к образованию карбида кальция при нагревании твердого оксида кальция и кокса (углерода) в электрической печи:
СаО(тв) + 3С(тв:) → СаС2(тв) + CO(г)↑
Значение константы равновесия этой реакции при температуре ~2500°С близко к единице. Однако удаление из реакционной системы газа приводит к уменьшению концентрации продуктов реакции. Это благоприятствует протеканию прямой реакции.
При промышленном получении белого пигмента диоксида титана осуществляется реакция между газообразными тетрахлоридом титана и кислородом:
ТlСl4(г) + O2(г) → TiO2(тв) + 2Сl2(г)↑
Продукт отделяют от реакционной газовой смеси в виде тонкоизмельченного порошка ТiO2. Уменьшение концентрации продуктов реакции и в этом случае сопровождается преимущественным протеканием прямой реакции.
Увеличение концентраций исходных веществ и уменьшение концентраций продуктов смещает химическое равновесие вправо, а увеличение концентраций продуктов и уменьшение концентраций исходных веществ — влево.
2. Давление.
При постоянной температуре константа равновесия не изменяется при изменении давления. Однако соотношение количества вещества реагентов и продуктов при изменении давления может измениться за счет смещения равновесия в направлении, соответствующем принципу Ле Шателье — Брауна.
Влияние давления на равновесные системы, в составе которых нет газов, пренебрежимо мало. Если в химическом равновесии принимают участие газы и количество вещества газообразных веществ в правой и левой части соответствующего химического уравнения различаются, при повышении давления равновесие смещается в сторону меньшего количества вещества газообразных веществ. В соответствии с этим принципом при понижении давления равновесие смещается в сторону образования большего количества вещества газообразных веществ.
Следует отметить, что увеличение объема равновесной системы равноценно уменьшению давления, а уменьшение объема — увеличению давления Рассмотрим одну из реакций с участием газов:
N2O4(г) D 2NO2(r)
Константа равновесия этой реакции имеет следующий вид:
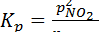 ;
;
Парциальные давления газов (р) связаны с полным давлением системы (Р) следующими соотношениями:
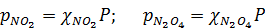
где χ — молярные доли соответствующих газов.
Подставив выражения для парциальных давлений в уравнение для константы равновесия, получим
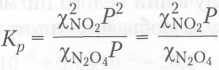
При постоянной температуре правая часть уравнения тоже постоянная величина. Следовательно, если полное давление Р в системе возрастает то отношение должно уменьшится. Это означает, что доляχ(NO2) будет уменьшаться, а доляχ(N2O4) – увеличиваться, другими словами, буди протекать обратная реакция.
3. Температура.
Зависимость положения химического равновесия от температуры определяется тепловым эффектом реакции. При повышении температуры мы привносим в систему тепло, поэтому согласно принципу Ле Шателье—Брауна происходит смещение равновесия в сторону эндотермической реакции. Если же мы понижаем температуру, равновесие смещается в сторону экзотермической реакции.
Рассмотрим взаимодействие между водородом и иодом:
Н2(г) + I2(г) D2НI(г)
Данная реакция является эндотермической (∆Н>0). Понижение температуры вызовет смещение равновесия в сторону обратной реакции. Наоборот, повышение температуры создаст более благоприятные условия для протекания прямой реакции (образование HI). Таким образом, можно заключить, что равновесие смещается в ту сторону, которая компенсирует эффект поступления тепла извне (повышение температуры) либо эффект его отвода (понижение температуры).
Если прямая реакция в равновесной системе является экзотермической (∆Н<0), то при повышении температуры константа равновесия уменьшается. Если же прямая реакция — эндотермическая, то при повышении температуры константа равновесия увеличивается.
Катализатор.
Катализатор — вещество, которое увеличивает скорость химической реакции. В обратимой, протекающей в обоих направлениях, реакции катализатор в одинаковой степени увеличивает скорость и прямой, и обратной реакции. Отметим, что катализатор не оказывает влияния на концентрации продуктов и реагентов, а также на константу равновесия. Его влияние сказывается только на скорости, с которой достигается это равновесие.
Константа равновесия является функцией температуры, но не зависит от концентрации реагентов или продуктов, давления, а также от наличия или отсутствия катализатора.
В таблице суммировано влияние различных факторов на равновесие (принцип Ле Шателье—Брауна) для реакции
аА+ bВ D сС+ dD; ∆Н > 0 (а + b > с + d).
Влияние разных факторов на состояние равновесия
| Изменение условий | Скорость реакций х | Состав равновесной смеси по сравнению с исходной | Константа равновесия К |
| Повышение температуры | Возрастает | Больше С и D | Увеличивается |
| Понижение температуры | Уменьшается | Больше А и В | Уменьшается |
| Повышение давления | Возрастает для газовых реакций | Больше С и D | Не изменяется |
| Понижение давления | Уменьшается для газовых реакций | Больше А и В | -//- |
| Увеличение концентрации А и В | Возрастает для прямой реакции | Больше С и D | |
| Увеличение концентрации С и D | Возрастает для обратной реакции | Больше А и В | |
| Внесение катализатора | Возрастает | Не изменяется |
Дата добавления: 2021-09-07; просмотров: 388;











