Основы термодинамики
Лекция 10
Термодинамическая система (ТДС). Параметры состояния. Термодинамическое равновесие. Внутренняя энергия. Взаимодействие ТДС. Работа и теплота как форма обмена энергиями между ТДС. Равновесные и неравновесные процессы. Функции состояния и функции процесса.
Термодинамика это наука, которая изучает взаимосвязь между всеми видами энергии и влияние этой связи на свойства физических тел (систем). Особое положение термодинамики в физике связано с тем, что любая форма энергии при ее превращениях, в конце концов, переходит в энергию тепловых движений.
Термодинамика основана на двух основных законах, которые называются началами термодинамики.
Сформулируем одно из многих определений этих начал.
Первое начало термодинамики: невозможно возникновение или уничтожение энергии.
Второе начало термодинамики: невозможен процесс единственным результатом, которого было бы превращение теплоты в работу.
Американский физик Чарльз Сноу на примере 2-го начала термодинамики в книге «Две культуры» демонстрирует разрыв в культурном отношении между специалистами и неспециалистами в области естественных наук: «… и те и другие могут обсуждать произведения Шекспира, но, как только спор коснется соответствующих аспектов II-го начала термодинамики, дискуссию могут продолжать только те, кто имеет естественно-научное образование».
Чтобы было очевидно значение этих законов для науки и техники их можно сформулировать иначе. Для этого надо ввести понятие о вечном двигателе.
Двигатель, повторяющий один и тот же процесс и способный производить (выполнять) работу большую, чем полученная им энергия называется вечным двигателем первого рода.
Тепловой двигатель, повторяющий один и тот же процесс и способный целиком преобразовать в работу всю теплоту, которую он получает от других тел, называется вечным двигателем второго рода.
Было сделано множество попыток сконструировать вечный двигатель, но ни одна из них не удалась. Объяснение этому дают два начала термодинамики.
I начало: вечный двигатель первого рода не возможен.
II начало: вечный двигатель второго рода не возможен.
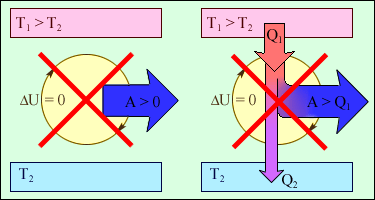
Рис.1 Циклически работающие тепловые машины, запрещаемые первым законом термодинамики: 1 – вечный двигатель 1 рода, совершающий работу без потребления энергии извне; 2 – тепловая машина с коэффициентом полезного действия η > 1.
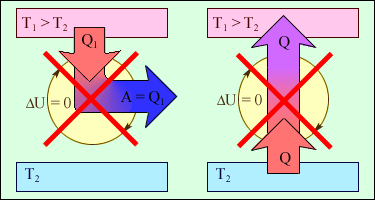
Рис.2 Процессы, не противоречащие первому закону термодинамики, но запрещаемые вторым законом: 1 – «вечный двигатель второго рода»; 2 – самопроизвольный переход тепла от холодного тела к более теплому («идеальная холодильная машина»).
Согласно вышесказанному наибольший практический интерес представляет преобразование тепловой энергии в механическую и наоборот. Однако прежде чем рассматривать эти вопросы необходимо рассмотреть термодинамическую систему, параметры ее состояния, виды процессов и т.д.
Термодинамическая система (ТДС) - это совокупность макроскопических тел, которые могут взаимодействовать между собой и с другими телами (внешней средой) - обмениваться с ними энергией и веществом. В частности, термодинамическая система может состоять из одногомакроскопического тела.
Физические величины, которые характеризуют состояние ТДС, называются термодинамическими параметрами состояния или просто параметрами состояния. Обычно в качестве параметров состояния выбирают объем V, который занимает масса вещества m, давление p и температуру T. Эти параметры не независимые. Они связаны уравнением состояния.
Самая простая ТДС – газ, который характеризуется параметрами p,V,T. Более сложная ТДС – двухфазная – жидкость, которая находится в равновесии с насыщенным паром.
ТДС могут быть частично или полностью изолированными. Если ТДС находится в теплонепроницаемой (адиабатной) оболочке она изолирована в тепловом отношении. При этом она может быть не изолирована в механическом отношении (перемещение поршня в теплоизолированном цилиндре). Если ТДС ни каким образом не взаимодействует с окружающей средой, то она полностью изолированная (замкнутая).
Система находится в термодинамическом равновесии, если макроскопические параметры, характеризующие ее состояние, остаются постоянными сколь угодно долго. Очевидно, что в состоянии равновесия не могут протекать такие процессы как диффузия, теплопередача, фазовые переходы, химические реакции и т.д.
Опыты показывают, что если параметры состояния в разных точках системы не одинаковые – нет состояния равновесия, то с течением времени система сама по себе перейдет в состояние равновесия. Процесс перехода термодинамической системы из неравновесного состояния в равновесное называется процессом релаксации, он характеризуется временем релаксации. Термодинамическое равновесие отличается от механического тем, что при неизменных макроскопических параметрах, характеризующих состояние системы, микроскопические величины – скорости, импульсы, энергия молекул беспрерывно изменяются. Тот факт, что система при этом остается в состоянии равновесия, обусловлен огромным количеством молекул.
Если процесс протекает достаточно медленно, то в любой момент система близка к своему равновесному состоянию. Такие процессы называются квазистатическими. В привычном для нас масштабе времени эти процессы могут протекать и не очень медленно. Например, разрежения и сжатия газа в звуковой волне, происходящие сотни раз в секунду, можно рассматривать как квазистатический процесс. Квазистатические процессы могут быть изображены на диаграмме состояний (например, в координатах p,V) в виде некоторой линии, каждая точка которой представляет равновесное состояние.
Любая система (тело) обладает внутренней энергией. Внутренняя энергия системы это сумма всех видов энергии, которой обладают частички системы.
Внутренняя кинетическая энергия частичек обусловлена их тепловым движением. С ростом T кинетическая энергия увеличивается. Внутренняя потенциальная энергия зависит от взаимодействия частичек. Она изменяется как при изменении T, так и при изменении агрегатного состояния системы. Для тела (системы) внутренняя энергия тем больше, чем больше в нем находится частичек, т.е. чем больше масса тела. Следовательно, внутренняя энергия величина аддитивная.
Определим внутреннюю энергию идеального газа массой m. Энергия одной молекулы:
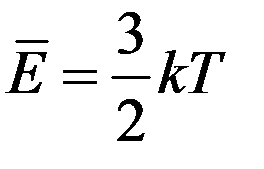 (1)
(1)
Для газа массой m:
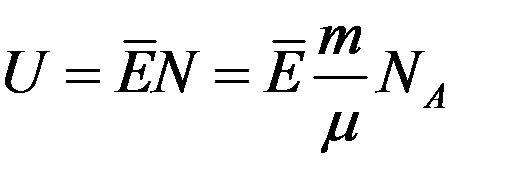 (2)
(2)
где N – число молекул в массе газа m.
С учетом (1) из (2) получим:
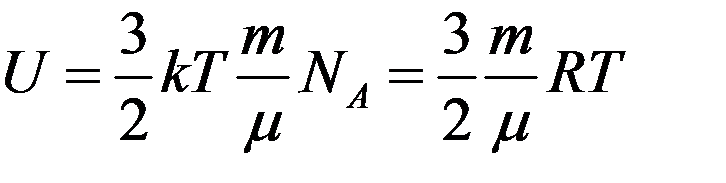 (3).
(3).
К внутренней энергии также относится внутриядерная энергия, эйнштейновская энергия покоя Eo= mc2. Однако в большинстве задач термодинамики эти виды энергии остаются постоянными. На них можно не обращать внимания, так как в термодинамике важно не абсолютное значение внутренней энергии, а ее изменение, которое происходит в разных процессах.
Очевидно, что внутренняя энергия однозначно является функцией параметров состояния. Если система в результате каких-либо процессов, в которых изменяются ее параметры состояния, возвратилась в первоначальное состояние, то при этом изменение внутренней энергии равно нулю ΔU = 0. С математической точки зрения это означает, что внутренняя энергия является полным дифференциалом функции параметров состояния. Следовательно, изменение внутренней энергии при переходе системы из одного состояния в другое всегда будет равно разности внутренних энергий в этих состояниях, и не будет зависеть от вида процесса перехода системы из одного состояния в другое.
В природе, на практике ТДС взаимодействуют между собой, при этом изменяются их параметры состояния, их внутренние энергии. В зависимости от формы передачи энергии взаимодействия делятся на тепловые и адиабатные.
Адиабатным взаимодействием называется обмен энергиями между системами, происходящий вследствие выполнения макроскопической работы. Макроскопическая работа выполняется при изменении внешних параметров и не связана с теплопередачей.
Физическая величина, равная энергии, которой системы обмениваются при адиабатном взаимодействии, называется работой.
Найдем элементарную работу, которую выполняет газ при расширении, перемещая поршень в цилиндре (рис.1).
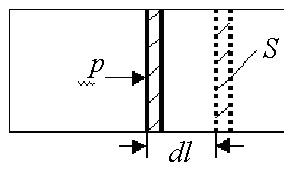
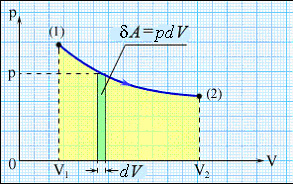
Рис.1.Работа газа при расширении
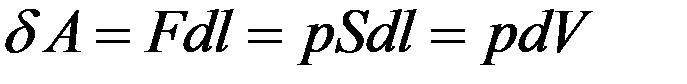 (4)
(4)
где S – площадь поршня, Sdl = dV – изменение объема газа. dl настолько мало, что p = const.
Если газ, расширяясь, выполняет работу, то dV > 0 и δA > 0. При сжатии газа dV < 0 и δA < 0, в этом случае работа выполняется над газом внешним силами. Полная работа расширения или сжатия газа при изменении объема от V1 до V2 находится интегрированием (4):
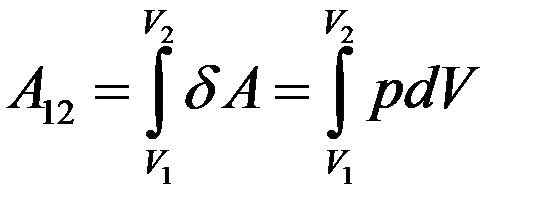 (5)
(5)
Графически работа изображается площадью фигуры, лежащей под кривой p(V) (рис.1) и численно равна площади под кривой 1→2.
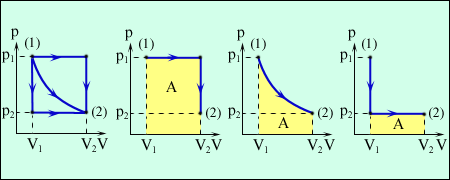
Рис.2. Три различных пути перехода из состояния (1) в состояние (2).
Во всех трех случаях газ совершает разную работу, равную площади под графиком процесса. Таким образом, работа не определяется только начальным и конечным состояниями газа, а зависит от всего хода процесса. Следовательно, интеграл (5) зависит от пути интегрирования и поэтому подынтегральное выражение δA не является полным дифференциалом какой-либо функции состояния газа. Поэтому нельзя говорить о «запасе» работы в каком-либо состоянии системы. Выражение δA отличается по смыслу от dU. dU означает приращение внутренней энергии, а δA – элементарная, бесконечно малая работа.
При контакте горячего и холодного тел внутренняя энергия их будет изменяться, хотя при этом макроскопическая работа не выполняется.
Процесс обмена внутренними энергиями при взаимодействии ТДС благодаря теплопередаче, и при котором не выполняется макроскопическая работа, называется теплообменом. Механизмы теплообмена: теплопроводность, излучение, конвекция.
Физическая величина, равная энергии, которой системы обмениваются при теплообмене, называется количеством теплоты. Теплота есть мера полученной или отданной энергии хаотического движения молекул.
Известно, что при переданном количестве теплоты δQ изменение температуры системы зависит от процесса, который при этом протекает. Это значит, что величина δQ не определяет однозначно изменение температуры (состояния) ТДС.
Следовательно, количество теплоты не является функцией параметров состояния, а, как и работа, является функцией процесса. δQ – означает не приращение, а элементарное, бесконечно малое количество теплоты. Нельзя говорить о «запасе» теплоты, которым система обладает в разных состояниях.
Любое изменение состояния ТДС, связанное с изменением ее термодинамических параметров, называется термодинамическим процессом. Переход ТДС из состояния 1 в состояние 2 осуществляется в результате процесса, который представляет собой последовательный ряд состояний, сменяющихся одно другим. Можно представить такой процесс, когда каждое промежуточное состояние будет равновесным. Для этого параметры двух соседних состояний должны отличаться на бесконечно малую величину.
Процесс, который складывается из ряда равновесных состояний, следующих одно за другим, называется квазистатическим или равновесным.
При таком процессе в каждый данный момент времени состояние газа практически не отличается от статического равновесного состояния, при котором параметры состояния одинаковые по всему объему.
Квазистатический процесс может быть только бесконечно медленным, чтобы в системе во всех точках происходило выравнивание всех параметров.
Квазистатические процессы упрощают исследования. Для описания системы, выполняющей квазистатический процесс необходимо столько параметров, сколько и для описания равновесного состояния.
Квазистатические процессы в природе не реализуются. К ним можно только приблизиться.
Процессы расширения газа в двигателях внутреннего сгорания, компрессорах, сжатия и разрежения газа при распространении звуковой волны приблизительно могут считаться квазистатическими. К квазистатическим процессам относятся изопроцессы: изотермический, изобарический и изохорический.
Лекция 11
Дата добавления: 2017-09-01; просмотров: 2797;











