Средняя длина и среднее время свободного пробега молекул. Явления переноса в газах. Диффузия.
Столкновения между молекулами играют очень важную роль во всех процессах, происходящих в газах. В частности, столкновения устанавливают равновесное распределение (Максвелловское) молекул по скоростям. Столкновения это и есть тот механизм, обеспечивающий переход газа к равновесному состоянию.
В идеальном газе столкновения происходят только между двумя молекулами. На одновременные столкновения между тремя и большим числом молекул можно не обращать внимания, так как они происходят достаточно редко. Столкновения молекул - случайные события. Их число зависит от скорости молекул, их размеров и концентрации. При столкновении молекулы сближаются до некоторого минимального расстояния, которое условно считается равным сумме радиусов молекул, взаимодействующих между собой.
Молекулы в этом случае надо представлять как твердые, упругие шарики с радиусами r1 и r2. Если газ однородный, то r1 = r2 = r. Столкновение между молекулами происходят только в случае, если их центры сближаются на расстояние равное сумме их радиусов r = r = 2r (рис.1).
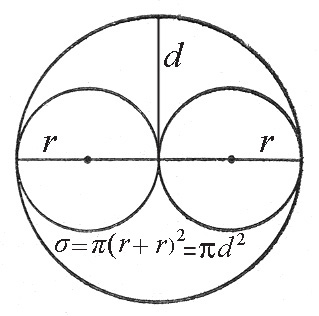
Рис.1. К расчету сечения рассеяния.
Иначе говоря, столкновение происходит только в том случае, если центры молекул окажутся внутри окружности площадью:
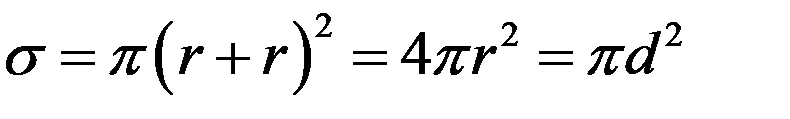 (1)
(1)
Величина σ называется эффективным сечением рассеяния молекул, или просто сечением рассеяния. Величина d, то есть минимальное расстояние между центрами молекул при столкновении, называется эффективным диаметром молекулы.
В момент столкновения изменяется величина и направление скорости молекулы, после чего она движется прямолинейно до следующего столкновения. Расстояние, которое молекула проходит между столкновениями – случайная величина.
Среднее расстояние, которое молекула проходит между двумя последовательными столкновениями называется средней длиной свободного пробега молекул.
Число столкновений молекулы в единицу времени, очевидно, также является случайным.
Ее среднее значение называется средним числом столкновений молекулы в единицу времени.
Эти две связанные между собой величины – являются главными характеристиками процесса столкновения газовых молекул.
Определим эти величины. Предположим, что все молекулы газа неподвижны, кроме одной. Из-за столкновений с неподвижными молекулами она будет двигаться по ломаной линии (рис.2).
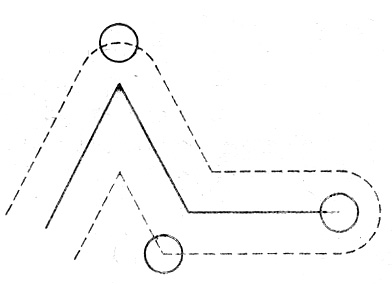
Рис.2. Траектория движения молекулы.
Пусть эффективный диаметр молекулы d. Она будет сталкиваться с теми неподвижными молекулами, центры которых находятся внутри цилиндра с площадью основания равной эффективному сечению рассеяния σ, т.е. окружности диаметром 2d (рис.3).
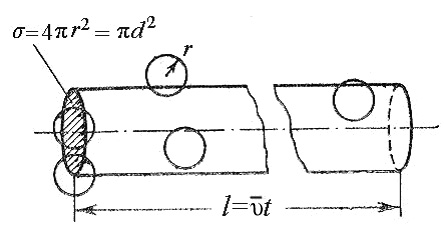
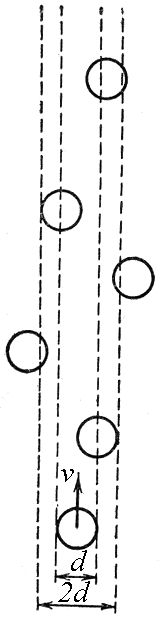
Рис.3. К расчету средней длины свободного пробега молекул.
Объем такого цилиндра равен пути, который молекула проходит за единицу времени, умноженному на σ:
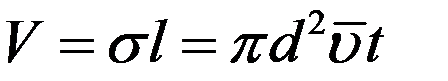
где 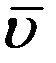 – средняя арифметическая скорость. Так как t = 1с то:
– средняя арифметическая скорость. Так как t = 1с то:
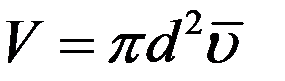 (2)
(2)
Ошибка, которая допускается при замене ломаного цилиндра на прямой незначительная, так как длина каждого прямого отрезка много больше, чем диаметр цилиндра.
Умножим объем цилиндра на концентрацию молекул n. В результате получим число молекул, находящихся в цилиндре, таким же будет и число столкновений рассматриваемой молекулы в единицу времени.
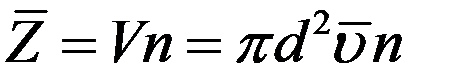 (3)
(3)
Однако следует учесть, что движется не одна, а все молекулы, поэтому число столкновений будет определяться не средней скоростью молекулы по отношению к стенкам сосуда (абсолютная скорость), а средней относительной скоростью (относительно движущихся молекул).
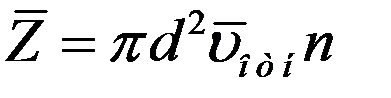 (4)
(4)
Пусть до столкновения молекулы движутся со скоростями υ1 и υ2 (рис.4).
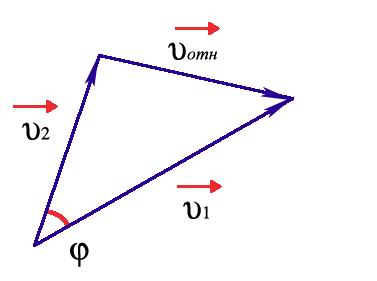
Рис. 4. К расчету относительной скорости.
Относительная скорость движения одной молекулы относительно другой:
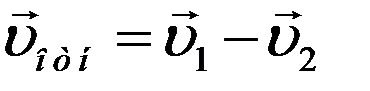
Из рисунка видно, что:
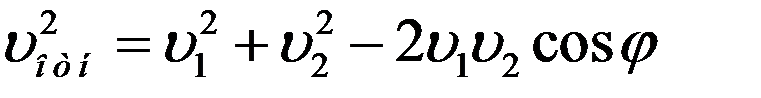
Известно, что среднее значение суммы нескольких величин равно сумме средних значений этих величин.
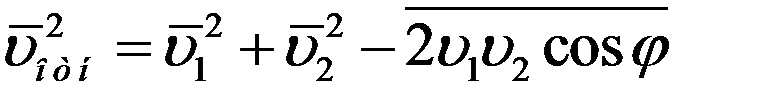
Среднее значение квадратов абсолютных скоростей всех молекул одинаковое. Угол φ может принимать значения от 0 до π, поэтому среднее значение
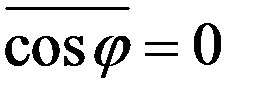
Учитывая вышеизложенное, получим:
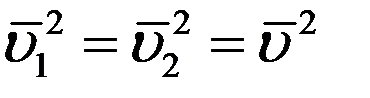
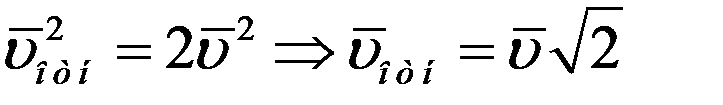
Средняя относительная скорость движения одной молекулы относительно другой в 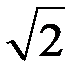 раз больше средней абсолютной скорости молекул. С учетом этого из (4) получим среднее число столкновений молекулы в единицу времени:
раз больше средней абсолютной скорости молекул. С учетом этого из (4) получим среднее число столкновений молекулы в единицу времени:
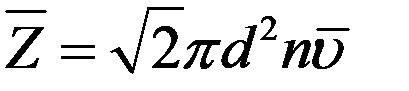 (5)
(5)
При нормальных условиях (p = 1,01·105 Па, T = 273 K) значение 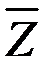 из (5) составляет ~109 с-1.
из (5) составляет ~109 с-1.
Такое большое значение числа столкновений объясняет факт медленного движения молекул в определенном направлении, несмотря на то, что тепловые скорости молекул достигают сотен метров в секунду (пример: распространение запахов).
Величина обратная 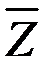 есть не что иное, как среднее время свободного пробега молекул:
есть не что иное, как среднее время свободного пробега молекул:
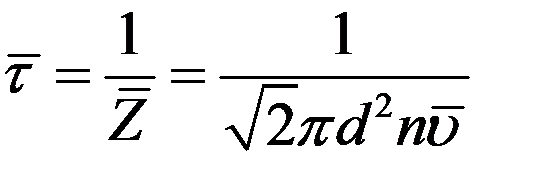 (6)
(6)
За время t молекула проходит путь 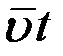 , за это же время молекула делает
, за это же время молекула делает 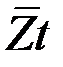 столкновений, следовательно, средняя длина свободного пробега молекул:
столкновений, следовательно, средняя длина свободного пробега молекул:
 (7)
(7)
При нормальных условиях 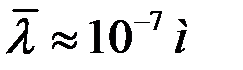 .
.
Известно, что p = nkT. С учетом этого из (7) получим:
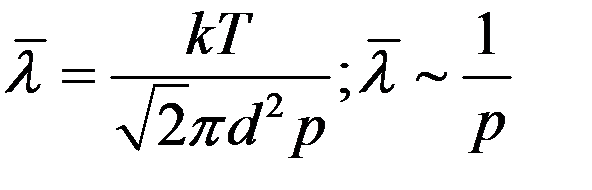 (8)
(8)
Из (8) видно, что 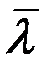 обратно пропорциональна давлению при постоянной температуре. Из (7) следует, что
обратно пропорциональна давлению при постоянной температуре. Из (7) следует, что 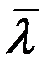 не зависит от температуры. На самом деле эффективный диаметр молекулы d зависит (слабо) от температуры (от кинетической энергии сталкивающихся молекул). Зависимость
не зависит от температуры. На самом деле эффективный диаметр молекулы d зависит (слабо) от температуры (от кинетической энергии сталкивающихся молекул). Зависимость 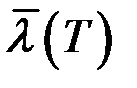 выражается формулой Сезерленда:
выражается формулой Сезерленда:
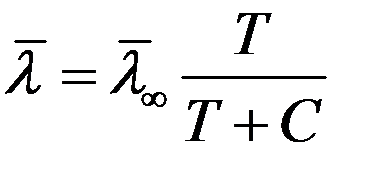 (9)
(9)
где C – характерная для каждого газа постоянная величина, которая имеет размерность температуры и называется постоянной Сезерленда. 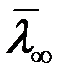 - средняя длина свободного пробега молекулы при T→∞.
- средняя длина свободного пробега молекулы при T→∞.
Равновесное состояние газа в МКТ всегда связано с хаотичным движением молекул, скорости которых распределены по Максвеллу. Любые неравновесные состояния газа связаны с нарушением Максвелловского распределения молекул по скоростям. Основная особенность неравновесного состояния – стремление газа самопроизвольно перейти к равновесному состоянию. Это обусловлено тепловым движением молекул и их беспрерывными столкновениями.
Установление в газе равновесного состояния с Максвелловским распределением по скоростям всегда связано с направленным переносом массы, импульса и энергии. Процессы переноса этих величин называются явлениями переноса. К явлениям переноса относятся: диффузия, внутреннее трение, теплопроводность. Диффузия обусловлена переносом массы, внутреннее трение – переносом импульса, теплопроводность – переносом энергии.
Диффузия.Диффузией называется процесс проникновения одного газа в объем другого, или движение газа из области с высокой концентрацией молекул в область, где она ниже.
Процесс диффузии заключается в том, что каждый из компонентов смеси переходит из тех мест, где его концентрация больше в те, где его концентрация меньше, это значит в направлении уменьшения концентрации.
Фик экспериментально установил, что масса вещества, переносимая через площадку dS в направлении нормали к площадке, за время dt, пропорциональна градиенту плотности в направлении переноса:
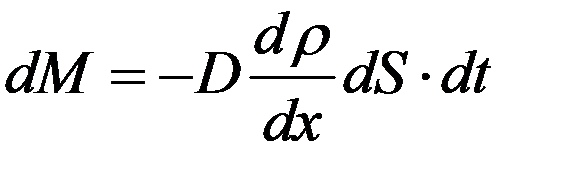 (10)
(10)
где dM – масса перенесенного вещества,  - градиент плотности газа в направлении x, D – коэффициент диффузии, который зависит от рода газа и от условий, в которых газ находится.
- градиент плотности газа в направлении x, D – коэффициент диффузии, который зависит от рода газа и от условий, в которых газ находится.
Физический смысл D: коэффициент диффузии численно равен массе вещества перенесенной через единичную площадку в единицу времени, в направлении нормали к площадке, при единичном градиенте плотности.
(10) –закон Фика. Знак “-“ в правой части (10) показывает, что диффузионный поток направлен в сторону уменьшения плотности.
Рассмотрим самодиффузию газа (рис.4).
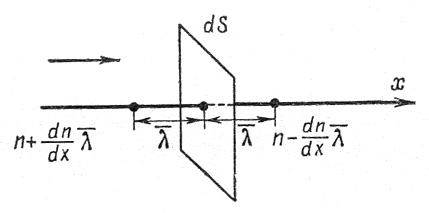
Рис.4. К расчету коэффициента диффузии.
Предположим, что концентрация молекул в том месте, где расположена площадка dS, равна n, а градиент концентрации молекул вдоль оси x – dn/dx. Тогда на расстоянии 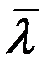 по обе стороны от площадки концентрации молекул будут соответственно равны:
по обе стороны от площадки концентрации молекул будут соответственно равны:
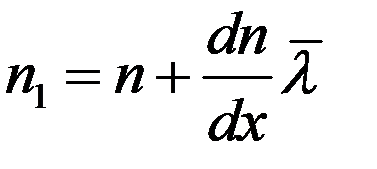 (11)
(11)
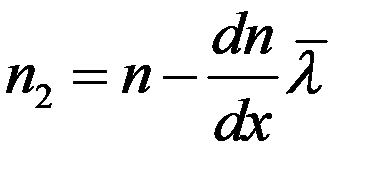 (12)
(12)
Молекулы движутся хаотично, следовательно, все направления движения равновероятны. Тогда в направлении оси x будет двигаться 1/3 всех молекул. Из них половина, т.е. 1/6 будет двигаться слева направо, а вторая половина справа налево. Так как молекулы не сталкиваются друг с другом на пути 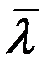 , то за время dt через площадку dS слева на право пройдет
, то за время dt через площадку dS слева на право пройдет
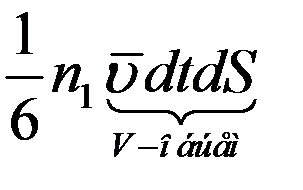
молекул, а в обратном направлении
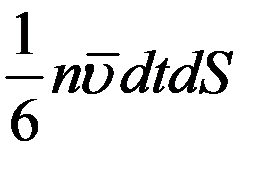
молекул, где 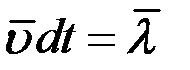 . Суммарное число молекул, которое проходит через площадку dS за время dt слева направо будет равно:
. Суммарное число молекул, которое проходит через площадку dS за время dt слева направо будет равно:
 (13)
(13)
Суммарное число молекул, которое проходит через площадку dS за время dt справа налево подсчитывается аналогично:
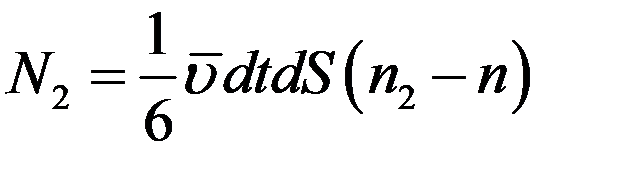 (14)
(14)
Разность (14) и (13) даст общее число молекул, которые проходят через площадку dS за время dt в положительном направлении оси x:
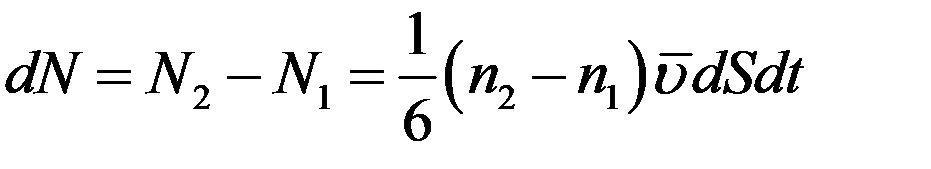 (15)
(15)
С учетом (11) и (12) из (15) получим:
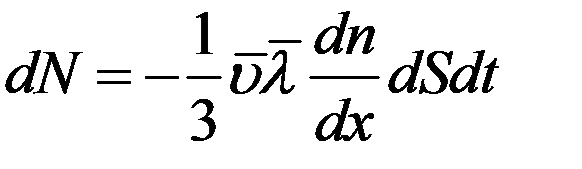 (16)
(16)
Умножим левую и правую часть (16) на массу одной молекулы m:
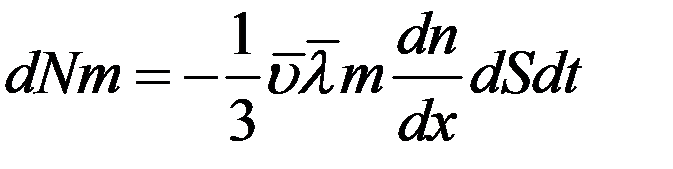 (17)
(17)
В (17) dNm = dM – масса газа, которая переносится через площадку dS за время dt, а величина:
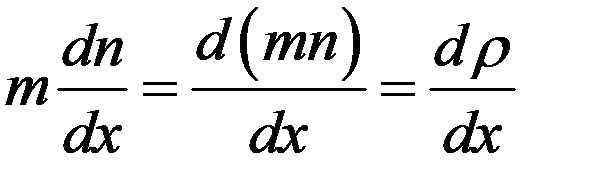
градиент плотности, где mn = ρ – плотность газа. С учетом этого перепишем (17) в виде:
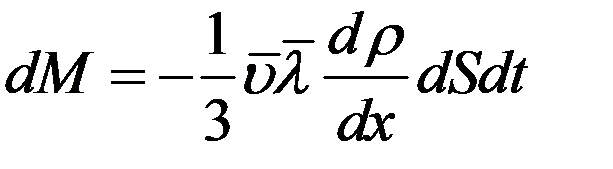 (18)
(18)
Сравнивая (18) с законом Фика (10) получим коэффициент диффузии:
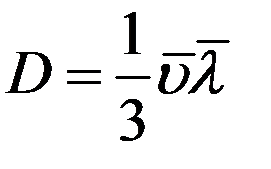 (19)
(19)
В системе CI:
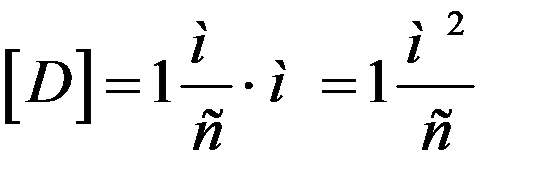
При T = const 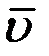 не зависит от давления p, а
не зависит от давления p, а 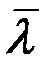 ~ 1/p, следовательно:
~ 1/p, следовательно:
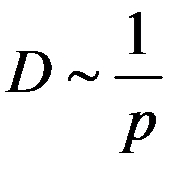
Коэффициент диффузии зависит от температуры, поскольку:
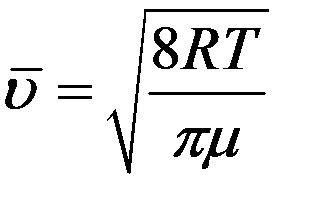 .
.
Следовательно 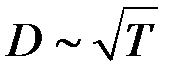 . Опыты показывают, что при повышении температуры D возрастает быстрее, чем
. Опыты показывают, что при повышении температуры D возрастает быстрее, чем 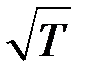 . Это объясняется тем, что при повышении температуры уменьшается эффективный диаметр молекул, что приводит к росту
. Это объясняется тем, что при повышении температуры уменьшается эффективный диаметр молекул, что приводит к росту 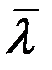 (формула Сезерленда), а, значит и к дополнительному увеличению D.
(формула Сезерленда), а, значит и к дополнительному увеличению D.
Лекция 8
Дата добавления: 2017-09-01; просмотров: 2242;











