Следствие из закона простых кратных соотношений
Относительная атомная (молекулярная) масса (АR, MR) – безразмерное число, показывающее, во сколько раз масса данного атома (молекулы) больше, чем 1/12 массы атома изотопа углерода 12С; измеряется в атомных единицах массы а.е.м.
Следствия из закона Авогадро
1) При одинаковых (внешних) условиях (T, P) одно и тоже число молекул различных газов будет занимать одинаковый объем (формулировка, обратная закону).
2) Массы двух газов, взятых в равных объемах и при одних и тех же условиях, должны относиться друг к другу как их молярные массы:
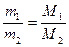
Отношение масс газов – это относительная плотность одного газа по другому (для V1=V2 и одинаковых P, T):
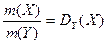
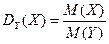
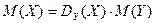
3) При нормальных условиях (00С, 101,325 кПа) 1 моль любого газа занимает объем 22,4 л.
Моль (ν) – количество вещества, содержащее столько же частиц вещества (молекул, атомов, ионов или любых других формульных единиц), сколько содержится атомов в 12 г изотопа углерода 12С.
Число Авогадро(NA) – 6,02·1023 частиц.
Молярная масса(M) – масса одного моля вещества; измеряется в г/моль.
Молярный объем (VM) – объем одного моля газа; измеряется в л/моль.
Полезные формулы
Связь между массой вещества m, количеством вещества ν и его молярной массой M:
 ,
,  или
или 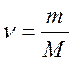
Связь между объемом вещества V, количеством вещества ν и его молярным объемом VM:
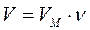 ,
, 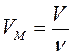 или
или 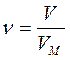
Дата добавления: 2021-09-07; просмотров: 432;











