Обобщенный газовый закон (уравнение Клапейрона-Менделеева)
Атомно-молекулярная теория
1.1.1. Основные положения
1. Все вещества состоят из молекул.
Молекула – сложная частица, состоящая из нескольких атомов и являющаяся наименьшей частицей вещества, обладающего всеми его химическими свойствами
2. Все молекулы состоят из атомов.
Атом – мельчайшая частица вещества, которую невозможно разделить на составные части, превратить в другой атом или уничтожить химическим путем. Атом – носитель свойств элемента.
3. Атомы разных элементов различаются по массе.
Химический элемент – совокупность атомов, имеющих одинаковый заряд ядра.
Совокупность одинаковых атомов образуют простое вещество.
4. Атомы различных химических элементов взаимодействует друг с другом в целочисленных соотношениях, образуя молекулы.
1.1.2. Основные законы
Закон сохранения массы(1748 г. – М.В. Ломоносов; 1789 г. – А.-Л. Лавуазье)
любое химическое превращение в закрытой системе не приводит к изменению массы системы.
Закон постоянства состава(1799 г. – Ж.Л.. Пруст)
состав чистого молекулярного вещества не зависит от способа его получения
Закон простых кратных соотношений(1804 – Дж. Дальтон)
если два элемента образуют между собой несколько соединений, то на одну и ту же массу первого элемента будут приходиться массы второго, соотносящиеся между собой как небольшие целые числа.
Закон простых объемных соотношений(1805 – Ж. Гей-Люссак)
объемы реагирующих газов относятся друг к другу и к объему газообразных продуктов как небольшие целые числа
Закон Авогадро(1811 г. – А. Авогадро)
в равных объемах газов при одинаковых условиях содержится одинаковое число молекул
Закон Дальтона
сумма парциальных давлений всех газов, входящих в смесь, равно общему давлению газовой смеси
Парциальное давление – это давление, которое создавал бы газ, если бы находился в том же объеме при той же температуре один
Обобщенный газовый закон (уравнение Клапейрона-Менделеева)
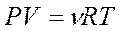
где Р – давление газа (газовой смеси) или парциальное давление газа (кПа), входящего в смесь; V – объем сосуда (л); ν – количество газа (газовой смеси) (моль); Т – температура (К); R – универсальная газовая постоянная (8,31 Дж/К·моль)[1].
Основные следствия
Дата добавления: 2021-09-07; просмотров: 441;











