Отклонения неидеальных растворов от закона Рауля.
Неидеальные растворы могут иметь как положительное, таки отрицательное отклонение от закона Рауля.
По объединенному закону Рауля-Дальтона общее давление в паровой фазе (над раствором) = сумме равновесных парциальных давлений, зависящих от упругости паров чистых НК и ВК при данной температуре (для бинарной смеси):
P= 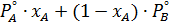
Проиллюстрируем этот закон для неидеальных растворов на диаграмме фазового равновесия “давление-состав”
а) Положительное отклонение от закона Рауля
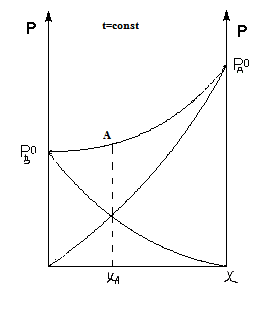
б) Отрицательное отклонение от закона Рауля
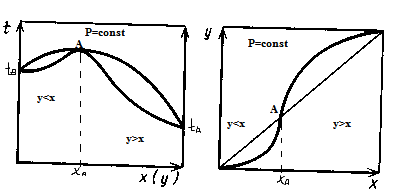
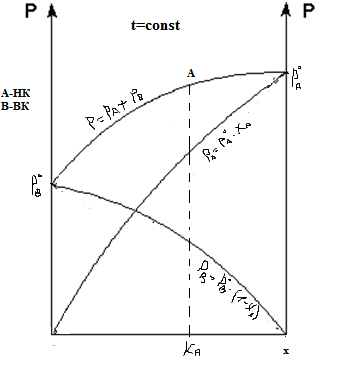
По 2-му закону Коновалова, max-м на диаграмме “давление-состав”
Соответствует min-му на диаграмме “t-ра- состав, состав” (при положительном отклонении от закона Рауля).
При отрицательном отклонении от закона Рауля min-му давления соответствует max-м температуры.
По общему закону Коновалова в азеотропной точке A составы жидкости и пара одинаковы, т.е. 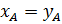 - общий закон Коновалова.
- общий закон Коновалова.
В азеотропной смеси с положительным отклонением от закона Рауля, левее точки А паровая фаза обогащается НК, а правее точки А- пар обогащается ВК.
В азеотропной смеси с отрицательным отклонением от закона Рауля левее точки А пар обогащается ВК, а правее точки А- пар обогащается НК.
По правилу Вревского, с увеличением общего давления в азеотропной смеси с min-м температуры кипения растет концентрация компонента с большей мольной теплотой испарения, а в азеотропной смеси с max-м температуры кипения увеличивается концентрация компонента с меньшей мольной теплотой испарения. Таким образом, при достаточно большом изменении давления, азеотропная точка исчезает:
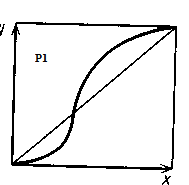
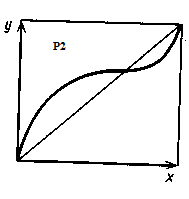
При данном давлении температура кипения и состав азеотропной смеси постоянны. Азеотропную смесь могут образовывать 2 или несколько компонентов.
Дата добавления: 2017-09-01; просмотров: 2698;











