Химические свойства солей
Соли могут взаимодействовать:
1°. С кислотами или с кислотными оксидами (сильная или малолетучая кислота вытесняет слабую или более летучую, неустойчивую кислоту из соли):
KCN + HCl = KCl + HCN
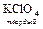 +
+ 
 KHSO4 + HClO4
KHSO4 + HClO4
Na2CO3 + SiO2 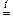 Na2SiO3 + CO2 .
Na2SiO3 + CO2 .
2°. С основаниями (сильное или менее летучее основание вытесняет слабое или более летучее основание из солей):
FeSO4 + 2NaOH = Fe(OH)2 ¯ + Na2SO4
NH4Cl + KOH = NH3 + H2O + KCl
[CH3NH3]Cl + NaOH = CH3NH2 + NaCl + H2O.
3°. С солями:
AgNO3 + NaCl = AgCl¯ + NaNO3.
При составлении уравнений реакций обмена между электролитами, необходимо учитывать условия протекания реакций до конца и пользоваться таблицей растворимости оснований, кислот и солей.
4°. С металлами, стоящими в электрохимическом ряду напряжений до металла, катион которого входит в состав соли (см. «получение солей» п. 3):
2 AgNO3 + Cu = 2 Ag ¯ + Cu(NO3)2.
При составлении уравнений подобных реакций не следует использовать металлы, стоящие в ряду электрохимических напряжений до магния, т. к. эти металлы прежде всего будут взаимодействовать с водой в результате чего образуется гидроксид, который и будет реагировать с солью, например, раствор CuSO4 + Na
2 Na + 2 H2O = 2 NaOH + H2
2 NaOH + CuSO4 = Cu(OH)2¯ + Na2SO4.
5°. Соли кислородсодержащих кислот разлагаются при нагревании:
2Cu(NO3)2 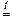 2CuO + 4NO2 + O2
2CuO + 4NO2 + O2
CaCO3 = CaO + CO2 (при t > 900°C).
6°. Если кислотообразующий элемент может находиться в нескольких степенях окисления, то используя подходящий окислитель или восстановитель можно перейти от соли одной кислоты к соли другой кислоты, в которой кислотообразующий элемент находится в другой степени окисления.
Na2SO3 + H2O2 = Na2SO4 + H2O.
Аналогично, если металл, входящий в состав соли может проявлять различные степени окисления, то можно перейти от одной соли к другой, в которой металл находится в иной степени окисления:
3 Fe(NO3)2 + 4 HNO3 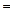 3 Fe(NO3)3 + NO + 2 H2O
3 Fe(NO3)3 + NO + 2 H2O
2 FeCl3 + Cu = 2 FeCl2 + CuCl2.
Дата добавления: 2021-09-07; просмотров: 477;











