Химические свойства кислот
1°. Рассмотрим характерные свойства кислот, не являющихся окислителями.
1°.1. Реакции обмена
а) Взаимодействие с основаниями (как с растворимыми, так и с нерастворимыми) — реакция нейтрализации:
NaOH + HCl = NaCl + H2O
Cu(OH)2 ¯ + H2SO4 = CuSO4 раствор + 2 H2O.
б) Взаимодействие с солями
BaCl2 + H2SO4 = BaSO4 ¯ + 2HCl
Na2SO3 + H2SO4 = Na2SO4 + SO2 + H2O.
При составлении уравнений реакций обмена необходимо учитывать условия протекания этих реакций до конца:
а) образование хотя бы одного нерастворимого соединения
б) выделение газа
в) образование слабого электролита ( например, воды)
1°.2. Реакции с основными и амфотерными оксидами:
а) FeO + H2SO4 = FeSO4 + H2O
б) ZnO + 2 HNO3 = Zn(NO3)2 + H2O.
1°.3. Металлы, стоящие в электрохимическом ряду напряжений до водорода, вытесняют водород из кислот, не являющихся сильными окислителями (HCl, H2SO4 (разб.)):
Zn + H2SO4 (разб.) = ZnSO4 + H2
Mg + 2 HCl = MgCl2 + H2.
Если в результате реакции образуется нерастворимая соль или оксид, то металл пассивируется и его растворение не происходит:
Pb + H2SO4 ¹
(PbSO4 — нерастворим в воде)
Al + HNO3 (конц.) ¹
(поверхность металла покрывается оксидной пленкой).
1°.4. Термически неустойчивые кислоты, например, угольная, сернистая, разлагаются при комнатной температуре или при легком нагревании:
H2CO3 = CO2 + H2O
H2SO3  SO2 + H2O
SO2 + H2O
SiO2 × x H2O  SiO2 + x H2O .
SiO2 + x H2O .
1°.5. Реакции с изменением степени окисления кислотообразующего элемента.
4 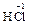 + MnO2 = MnCl2 +
+ MnO2 = MnCl2 + 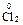 + 2 H2O
+ 2 H2O
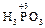 + H2O2 =
+ H2O2 = 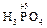 + H2O
+ H2O
2 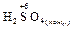 + Cu = CuSO4 +
+ Cu = CuSO4 + 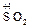 + 2 H2O
+ 2 H2O
2 H2S + H2SO3 = 3 S ¯ + 3 H2O.
По этому принципу кислоты можно разделить на кислоты-восстановители и кислоты-окислители.
2°. Свойства кислот-окислителей.
2°.1. Реакции обмена. Кислоты-окислители реагируют с оксидами, гидроксидами и солями, в состав которых входят катионы металлов не проявляющих переменные степени окисления также как и кислоты, не являющиеся окислителями (см. 1°.1 и 1°.2 в п. 2.4).
2°.2. Реакции с гидроксидами, оксидами и солями.
а) Если металл, образующий основание, может находиться в нескольких степенях окисления, а кислота проявляет окислительные свойства, то эти реакции могут протекать с изменением степеней окисления элементов, например:
Fe(OH)2 + 4 HNO3 (конц.) = Fe(NO3)3 + NO2 + 3 H2O.
б) Аналогично ведут себя в реакциях с кислотами-окислителями и оксиды металлов, проявляющих переменные степени окисления:
2 FeO + 4 H2SO4 (конц.) = Fe2(SO4)3 + SO2 + 4 H2O.
в) При реакциях кислот-окислителей с солями, содержащими анион, проявляющий восстановительные свойства, происходит его окисление:
3 Na2S + 8 HNO3 (разб.) = 6 NaNO3 + 3 S ¯ + 2 NO + 4 H2O
8 NaI + 5 H2SO4 (конц.) = 4 I2¯+ H2S + 4 Na2SO4 + 4 H2O.
2°.3. Взаимодействие с металлами.
Азотная и концентрированная серная кислоты являются сильными окислителями и могут взаимодействовать с металлами, стоящими в ряду напряжений как до, так и после водорода, но водород в этом случае не выделяется, а образуются продукты восстановления азота и серы, причем, состав продуктов зависит от активности металла, концентрации кислоты и температуры:
Cu + 4 HNO3 (конц.) = Cu(NO3)2 + 2 NO2 + 2 H2O
3 Cu + 8 HNO3 (разб.) = 3 Сu(NO3)2 + 2 NO + 4 H2O
5 Co + 12 HNO3 (оч.разб.) = 5 Co(NO3)2 + N2 + 6 H2O
4 Zn + 10 HNO3 (оч.разб.) = 4 Zn(NO3)2 + NH4NO3 + 3 H2O.
С разбавленной серной кислотой медь не взаимодействует, но реагирует с концентрированной серной кислотой, однако водород при этом не выделяется:
Cu + 2 H2SO4 (конц.) = CuSO4 + SO2 +2 H2O.
Некоторые металлы, стоящие в ряду напряжений до водорода, например, Fe, Al, Cr, эти кислоты пассивируют за счет образования на поверхности металла оксидной пленки нерастворимой в концентрированных кислотах при обычных условиях и поэтому указанные металлы не взаимодействуют с концентрированными серной и азотной кислотами.
2°.4. Реакции с неметаллами. Концентрированные азотная и серная кислоты взаимодействуют с неметаллами: серой, фосфором, углеродом:
S + 2 HNO3 (конц.)  H2SO4 + 2 NO
H2SO4 + 2 NO
S + 2 H2SO4 (конц.)  3 SO2 + 2 H2O
3 SO2 + 2 H2O
3 P + 5 HNO3 (конц.) + 2 H2O  3 H3PO4 + 5 NO
3 H3PO4 + 5 NO
C + 2 H2SO4 (конц.)  CO2 + 2 SO2 + 2 H2O.
CO2 + 2 SO2 + 2 H2O.
2°.5.Кислоты, образованные переходными металлами в высших степенях окисления, например, хромовая [H2CrO4], марганцовая [HMnO4], являются сильными окислителями.
2 H2CrO4 + 3 SO2 = Cr2(SO4)3 + 2 H2O.
Кислоты, в которых кислотообразующий элемент находится в промежуточной степени окисления могут проявлять как окислительные, так восстановительные свойства.
H2SO3 + 2 H2S = 3 S ¯ + 3 H2O (H2SO3 — окислитель)
H2SO3 + NO2 = H2SO4 + NO (H2SO3 — восстановитель).
Основания
В этом разделе будут рассмотрены только неорганические основания с позиции электролитической теории.
Дата добавления: 2021-09-07; просмотров: 490;











