Химические свойства оснований
Основания реагируют:
1°. С кислотами (а), кислотными (б) и амфотерными оксидами (в):
а) NaOH + HCl = NaCl + H2O
Cu(OH)2 ¯+ H2SO4 = CuSO4 + 2 H2O
б) 2 NaOH + SiO2 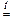 Na2SiO3 + H2O
Na2SiO3 + H2O
Ca(OH)2 + CO2 = CaCO3 + H2O
в) Al2O3 + 2 NaOH 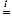 2 NaAlO2 + H2O
2 NaAlO2 + H2O
ZnO + 2 NaOH + H2O = Na2[Zn(OH)4].
2°. С солями (для растворимых в воде оснований):
2 NaOH + FeCl2 = Fe(OH)2¯ + 2 NaCl.
3°. С некоторыми неметаллами (в этих случаях, как правило, протекает реакция диспропорционирования):
6NaOH + 3Cl2 = 5NaCl + NaClO3 + 3H2O
6 NaOH + 3 S  2 Na2S + Na2SO3 + 3 H2O
2 Na2S + Na2SO3 + 3 H2O
3 KOH + 4 P + 3 H2O 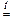 PH3 + 3 KH2PO2.
PH3 + 3 KH2PO2.
Взаимодействие кремния с раствором щелочи должно протекать подобно реакции фосфора со щелочью, но образующийся при этом силан (SiH4) взаимодействует с водой с образованием водорода и кремниевой кислоты, которая растворима в щелочах:
2 NaOH + Si + H2O = Na2SiO3 + 2 H2.
4°. С некоторыми металлами, гидроксиды которых амфотерны:
2 NaOH + Zn + 2 H2O = Na2[Zn(OH)4] + H2
2 NaOH + 2 Al + 10 H2O = 2 Na[Al(OH)4(H2O)2] + 3 H2.
5°. С различными веществами, при реакциях с которыми образуются комплексные соединения:
а) катионного типа:
Cu(OH)2 + 4 NH4OH = [Cu(NH3)4](OH)2 + 4 H2O.
б) анионного типа:
Cu(OH)2 + 4 HCN = H2[Cu(CN)4] + 2 H2O.
Глава 3
Соли
C точки зрения электролитической теории можно дать следующее определение этому классу соединений
Соли — электролиты, которые в водных растворах диссоциируют на катионы металлов или другие, более сложные, катионы, например, 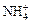 ,
, 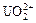 , [Cu(NH3)4]2+ и анионы кислотного остатка.
, [Cu(NH3)4]2+ и анионы кислотного остатка.
Дата добавления: 2021-09-07; просмотров: 433;











