Способы получения солей
Соли могут быть получены одним из ниже приведенных способов.
1°. Взаимодействием металлов
а) с кислотами:
Cr + 2 HCl = CrCl2 + H2 (без доступа воздуха)
Cu + 4 HNO3, конц. = Cu(NO3)2 + 2 NO2 + 2 H2O,
б) со щелочами:
2 Al + 2 NaOH + 10 H2O = 2 Na[Al(OH)4(H2O)2] + 3 H2.
2°. Нагреванием металлов с неметаллами в инертной атмосфере:
2 Fe + 3 Cl2 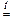 2 FeCl3
2 FeCl3
Zn + S  ZnS
ZnS
2 Li + H2  2 LiH
2 LiH
6 Mg + 2 N2  2 Mg3N.
2 Mg3N.
3°. Вытеснением металлов из солей другими металлами, стоящими в ряду напряжений до металла, входящего в состав соли:
Fe + CuSO4 = FeSO4 + Cu.
При этом не надо забывать, что если металл, входящий в состав соли, проявляет переменные степени окисления, то он может быть восстановлен до более низкой степени окисления металлом, находящимся в ряду напряжений правее его:
2 FeCl3 + Cu = 2 FeCl2 + CuCl2.
Эта реакция нашла применение электронной промышленности при изготовлении плат для печатного монтажа.
2 FeCl3 + Hg = 2 FeCl2 + HgCl2.
На этом основан способ очистки помещений от разлитой ртути.
4°. Взаимодействием неметаллов со щелочами (см. п. 3.3. Свойства оснований, 3°).
5°. Вытеснением активными неметаллами менее активных неметаллов из солей:
Cl2 + 2 NaBr = 2 NaCl + Br2.
В этом случае более электроотрицательный неметалл (хлор) вытесняет менее электроотрицательный (бром).
6°. Взаимодействием двух оксидов
| K2O основный оксид | + | SO2 кислотный оксид | = K2SO3 | ||||||||||
| Na2O основный оксид | + | Al2O3 амфотерный оксид | 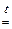 2 NaAlO2 2 NaAlO2
| ||||||||||
| ZnO амфотерный оксид | + | SO3 кислотный оксид | 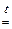 ZnSO4. ZnSO4.
| ||||||||||
7°. Нейтрализацией кислоты основанием (или амфотерным гидроксидом):
HNO3 + KOH = KNO3 + H2O
H2SO4 + Zn(OH)2 = ZnSO4 + 2H2O.
В случае многоосновных кислот (или многокислотных оснований) возможно образование кислых (или основных) солей, в зависимости от относительных количеств кислоты и основания, вступивших в реакцию:
H3PO4 + NaOH = NaH2PO4 + H2O
NaH2PO4 + NaOH = Na2HPO4 + H2O
Na2HPO4 + NaOH = Na3PO4 + H2O.
8°. Растворением или сплавлением кислотного или амфотерного оксида с основанием:
CO2 + 2KOH = K2CO3 + 2H2O
SiO2 + 2NaOH 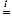 Na2SiO3 + H2O
Na2SiO3 + H2O
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Al2O3 + 2NaOH 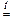 2NaAlO2 + H2O.
2NaAlO2 + H2O.
9°. Как результат реакции основного или амфотерного оксида с кислотой:
CuO + 2HCl = CuCl2 + H2O
ZnO + 2HNO3 = Zn(NO3)2 + H2O.
При этом необходимо учитывать возможность окисления катиона, образующего оксид, до более высокой степени окисления:
FeO + 4HNO3, конц. = Fe(NO3)3 + NO + 2 H2O.
10°. Взаимодействием пероксидов, надпероксидов и озонидов с кислотными оксидами:
2 Na2O2 + 2 CO2 = 2 Na2CO3 + O2
4 KO2 + 2 CO2 = 2 K2CO3 + 3 O2.
Эти реакции лежат в основе регенерации воздуха в замкнутых пространствах (подводные лодки, космические корабли, изолирующие противогазы).
11°. Осаждением нерастворимых в воде солей с образованием растворов кислот:
AgNO3 + HCl = AgCl ¯ + HNO3
Ca3(PO4)2 + 3 H2SO4 = 3 CaSO4¯ + 2 H3PO4.
Полученная соль не должна растворяться в образовавшейся кислоте.
12°. Взаимодействием кислотного оксида с солью:
SO2 + Na2CO3 = Na2SO3 + CO2
6 SiO2 + 2 Ca3(PO4)2  6 CaSiO3 + P4O10.
6 CaSiO3 + P4O10.
13°. Осаждением нерастворимых гидроксидов растворами щелочей из солей:
FeSO4 + 2 NaOH = Fe(OH)2¯ + Na2SO4.
14°. Как результат реакции обменна между солями с образованием одной нерастворимой соли:
BaCl2 + Na2SO4 = BaSO4¯ + 2NaCl.
15°. Термическим разложением солей:
Степень разложения солей определяется отношением заряда катиона (n+) к его радиусу (r). Чем больше это отношение, тем «глубже» степень разложения.
2 LiNO3  2 LiNO2 + O2
2 LiNO2 + O2
2 KClO3 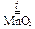 2 KCl + 3 O2.
2 KCl + 3 O2.
В некоторых случаях определяющую роль в разложении соли играет и заполненный 18-электронный подуровень катиона металла.
2 Cu(NO3)2 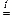 2 CuO + 4 NO2 + O2
2 CuO + 4 NO2 + O2
2 AgNO3  2 Ag + 2 NO2 + O2.
2 Ag + 2 NO2 + O2.
16°. Окислением или восстановлением кислотообразующего элемента, входящего в состав аниона соли:
Na2SO3 + H2O2 = Na2SO4 + H2O
Na2SO4 + 4C 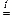 Na2S + 4CO.
Na2S + 4CO.
Дата добавления: 2021-09-07; просмотров: 495;











