Способы получения оснований
Основания могут быть получены одним из следующих способов.
1°. Взаимодействием щелочных и щелочноземельных металлов с водой:
2 Li + 2 H2O = 2 LiOH + H2
Sr + 2 H2O = Sr(OH)2 + H2.
Этим же способом может быть получен гидроксид аммония:
NH3 + H2O = NH3×H2O « 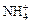 + OH –.
+ OH –.
В отличие от предыдущих примеров эта реакция протекает без изменения степеней окисления.
Другие металлы, стоящие в ряду электродных потенциалов до водорода, также могут реагировать с водой, но эти реакции протекают при высоких температурах и обратимы. При этом образуются не гидроксиды металлов, а оксиды, т. к. гидроксиды при этих температурах термически неустойчивы, например,
Fe + H2O « FeO + H2 (при t > 570°C).
2°. Растворением оксидов и пероксидов щелочных и щелочноземельных металлов в воде:
CaO + H2O = Ca(OH)2¯
Na2O2 + 2 H2O = 2 NaOH + H2O2.
Оксиды других металлов с водой не взаимодействуют.
3°. Гидролизом солей, у которых он протекает до конца:
Al2S3 + 6 H2O = 2 Al(OH)3¯ + 3 H2S .
4°. Смешиванием водных растворов солей, взаимно усиливающих гидролиз:
2 AlCl3 + 3 Na2CO3 + 3 H2O = 2 Al(OH)3¯ + 6 NaCl + 3 CO2.
5°. Разложением некоторых бинарных соединений металл-неметалл (гидридов, нитридов, фосфидов и др.) водой, например:
Li3N + 3 H2O = 3 LiOH + NH3
NaH + H2O = NaOH + H2
Ca3P2 + 6 H2O = 3 Ca(OH)2 + 2 PH3
Mg2Si + 4 H2O = 2 Mg(OH)2¯ + SiH4.
6°. Электролизом водных растворов хлоридов щелочных и щелочноземельных металлов:
2 NaCl + 2 H2O  2 NaOH + Cl2 + H2.
2 NaOH + Cl2 + H2.
Для получения гидроксидов этим способом необходимо разделить катодное и анодное пространства, иначе будет происходить взаимодействие хлора со щелочью с образованием других продуктов.
7°. Важнейшим способом получения слабых, нерастворимых в воде оснований является осаждение их из растворов солей щелочами или раствором аммиака
MgSO4 + 2 KOH = Mg(OH)2¯ + K2SO4
AlCl3 + 3 NH4OH = Al(OH)3¯ + 3 NH4Cl.
При осаждении амфотерных гидроксидов щелочами полноту осаждения можно достичь только при смешении строго эквимолярных количеств соли и щелочи. Поэтому для осаждения амфотерных гидроксидов используют раствор аммиака в воде. Аммиаком нельзя осаждать гидроксиды тех металлов, которые образуют с ним комплексные катионы.
Гидроксид аммония не может быть получен таким способом, т. к. повышение концентрации анионов OH – приводит к уменьшению растворимости аммиака в воде и выделению его из раствора в виде газа:
NH4Cl + NaOH = NH3 + H2O + NaCl.
Этот же способ применим и для получения растворимых в воде оснований:
Ca(OH)2 + Na2CO3 « 2 NaOH + CaCO3¯ (каустизация соды).
Сдвиг равновесия в сторону образования NaOH достигается за счет образования CaCO3, обладающего меньшей растворимостью, чем Ca(OH)2.
Для большего смещения равновесия в сторону образования гидроксида щелочного металла используют гидроксид бария и сульфат соответствующего щелочного металла:
Ba(OH)2 + Cs2SO4 = BaSO4¯ + 2 CsOH.
8°. Окислением катиона, находящегося в низшей степени окисления, до высшей:
4 Fe(OH)2 ¯ + O2 + 2 H2O = 4 Fe(OH)3 ¯.
Дата добавления: 2021-09-07; просмотров: 465;











