Уравнение Клапейрона-Менделеева
Для одного моля 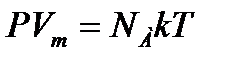 , где Vm – объем моля газа; NA•k=R; PVm =RT.
, где Vm – объем моля газа; NA•k=R; PVm =RT.
В любой массе содержится m/M молей (М – молярная масса). Уравнение Менделеева-Клапейрона 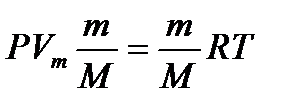 ;
; 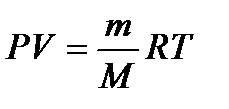 , где R=8,32 Дж/Кмоль – универсальная газовая постоянная. Это уравнение выражает объединенный закон газового состояния.
, где R=8,32 Дж/Кмоль – универсальная газовая постоянная. Это уравнение выражает объединенный закон газового состояния.
Реальный газ. Уравнение Ван-дер-Ваальса
Молекулы реального газа взаимодействуют друг с другом и имеют конечные размеры, поэтому уравнение состояния для него иное. Это уравнение получено в 1973 году Ван-дер-Ваальсом и имеет вид
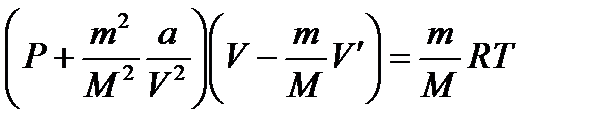 .
.
Сжижение газов
Практическое подтверждение изотерм Ван-дер-Ваальса выполнено Т. Эндрюсом в 1869г. Он экспериментировал с углекислым газом (СО2) с помощью термостатированного цилиндра с поршнем, снабженного манометром и шкалой объемов. Критической называется такая температура, выше которой газ, нельзя превратить в жидкость ни при каком давлении, а ниже которой можно тем при меньшем давлении, чем ниже температура. Понятие критической температуры сыграло большую роль в физике низких температур и технике сжижения газов. Для сжижения газов применяется машина К. Линде, основанная на положительном эффекте Джоуля-Томсона. При расширении реального газа в пустоту (то есть без совершения внешней работы) его температура понижается при низкой начальной температуре. Имеет место (и часто применяется) отрицательный эффект Джоуля-Томсона: при высокой начальной температуре газы, расширяясь, нагреваются.
При некоторой промежуточной температуре газ, расширяясь, не охлаждается и не нагревается. Такая температура называется температурой инверсии.
Вопросы для самоконтроля:
1) Какими параметрами характеризуется состояние газа?
2) Какими законами описываются изохорические, изобарические и изотермические
3) процессы? Как изображаются эти процессы графически?
4) Что означает число Авогадро?
5) Каким образом связана шкала по Кельвину со шкалой по Цельсию?
6) Каков физический смысл давления и температуры?
7) Какой газ называется реальным?
8) Напишите уравнения Клапейрона-Менделеева для моля и для любой массы газа.
9) Какая температура называется критической?
10) Какой физический закон используется при сжижении газа?
Список литературы
Основная
1.Рогачев, Н.М. Курс физики. Учебное пособие/ Н.М. Рогачев. –С.-Петербург: Издательство «Лань», 2010 г. - 448 с.
Дополнительная
1. Грабовский, Р.И. Курс физики. 6-е изд. / Р. И. Грабовский. – СПБ. : Издательство «Лань», 2002. – 608 с
Лекция 7
СВОЙСТВА ЖИДКОСТИ
Жидкость является агрегатным состоянием вещества, промежуточным между газообразным и твердым. В газах нет закономерности во взаимном расположении молекул (хаотическое расположение). В твердых телах наблюдается дальний порядок - молекулы образуют кристаллическую решетку. В жидкостях дальний порядок отсутствует, а имеет место ближний порядок в расположении молекул – их упорядоченное расположение повторяется на расстояниях, сравнимых с межатомными. Тепловое движение молекулы в жидкости это ее колебание около определенного положения равновесия в течение некоторого времени, после чего молекула скачком переходит в новое положение, отстоящее от исходного на расстояние порядка межатомного. Радиус r молекулярного действия –расстояние (порядка 10-9 м), при котором можно пренебречь силами притяжения между молекулами жидкости. Сфера радиусом r называется сферой молекулярного действия. Силы, действующие на молекулу внутри объема жидкости со стороны окружающих молекул, в среднем скомпенсированы. Для молекулы, расположенной на поверхности, равнодействующая сил R направлена внутрь жидкости. Результирующие силы всех молекул поверхностного слоя оказывают на жидкость молекулярное (внутреннее) давление.
Дата добавления: 2017-06-13; просмотров: 1269;











