Основы молекулярно-кинетической теории строения вещества
Основы молекулярно-кинетической теории разработаны М.В. Ломоносовым, Л.Больцманом, Дж. Максвеллом и др. Эта теория основана на следующих положениях:
1.Все вещества состоят из мельчайших частиц – молекул. Молекулы у сложных веществ состоят из еще более мелких частиц – атомов. Различные комбинации атомов создают виды молекул. Атом состоит из положительно заряженного ядра, окруженного отрицательно заряженной электронной оболочкой. Массу молекул и атомов измеряют в атомных единицах массы (а. е. м.). Диаметр атомов и молекул имеет порядок 10 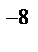 - 10
- 10 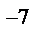 см. Количество вещества, в котором содержится число частиц (атомов или молекул) равное числу атомов в 0,012 кг изотопа углерода С
см. Количество вещества, в котором содержится число частиц (атомов или молекул) равное числу атомов в 0,012 кг изотопа углерода С 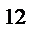 называется молем.
называется молем.
2.
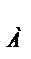 = 6.023*10
= 6.023*10 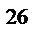 кмоль
кмоль 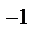 . Массу моля называет молярной массой. Между атомами и молекулами действуют силы взаимного притяжения и отталкивания. По мере увеличения расстояния (r) между молекулами силы отталкивания убывают быстрее, чем силы притяжения. При некотором определенном расстоянии (r
. Массу моля называет молярной массой. Между атомами и молекулами действуют силы взаимного притяжения и отталкивания. По мере увеличения расстояния (r) между молекулами силы отталкивания убывают быстрее, чем силы притяжения. При некотором определенном расстоянии (r 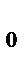 ) наступает равенство сил отталкивания и сил притяжения и молекулы находятся в состоянии устойчивого равновесия. Силы взаимодействия обратно пропорциональны n-й степени расстояния между молекулами (для f
) наступает равенство сил отталкивания и сил притяжения и молекулы находятся в состоянии устойчивого равновесия. Силы взаимодействия обратно пропорциональны n-й степени расстояния между молекулами (для f 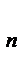 , n = 7; для f
, n = 7; для f 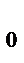 , n принимает значение от 9 до 15).Расстояние r
, n принимает значение от 9 до 15).Расстояние r 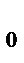 между молекулами соответствует минимуму их потенциальной энергии. Для изменения расстояния, отличного от r
между молекулами соответствует минимуму их потенциальной энергии. Для изменения расстояния, отличного от r 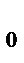 требуется затратить работу или против сил отталкивания или против сил притяжения; т.о. положение устойчивого равновесия молекул соответствует минимуму их потенциальной энергии. Молекулы, образующие тело, находятся в состоянии непрерывного беспорядочного движения.
требуется затратить работу или против сил отталкивания или против сил притяжения; т.о. положение устойчивого равновесия молекул соответствует минимуму их потенциальной энергии. Молекулы, образующие тело, находятся в состоянии непрерывного беспорядочного движения.
Молекулы сталкиваются друг с другом, изменяют скорость как по величине, так и по направлению. При этом происходит перераспределение их общей кинетической энергии. Состоящее из молекул тело рассматривается как система движущихся и взаимодействующих частиц. Такая система молекул обладает энергией, состоящей из потенциальной энергии взаимодействия частиц и из кинетической энергии движения частиц. Эту энергию и называют внутренней энергией тел. Количество внутренней энергии, передаваемой между телами при теплообмене, называется количеством теплоты (Джоуль, кал). Джоуль – СИ. 1 кал = 4,18 Дж. Атомы и молекулы находятся в непрерывном движении, которое называется тепловым. Основным свойством теплового движения является его бесперебойность (хаотичность). Для количественной характеристики интенсивности теплового движения вводится понятие температуры тела. Чем интенсивнее тепловое движение молекул в теле, тем выше его температура. При соприкосновении двух тел энергия переходит от более нагретого тела к менее нагретому и в конце концов устанавливается состояние теплового равновесия.
С точки зрения молекулярно-кинетических представлений температура есть величина, характеризующая среднюю кинетическую энергию поступательного движения молекул или атомов. За единицу измерения температуры тепла принят градус. (Сотая часть разности между температурами кипения и замерзания чистой воды при атмосферном давлении). В физику введена абсолютная температурная шкала Кельвина. Градус Цельсия равен градусу Кельвина. При температуре – 273 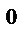 С должно прекратиться поступательное движение молекул газа (абсолютный нуль), т. е. система (тело) обладает наименьшей возможной энергией.
С должно прекратиться поступательное движение молекул газа (абсолютный нуль), т. е. система (тело) обладает наименьшей возможной энергией.
Основные положения молекулярно-кинетической теории строения вещества подтверждаются многочисленными опытами и явлениями (диффузия, броуновское движение, смешивание жидкостей, сжимаемость различных веществ, растворение в жидкостях твердых веществ и т. д.). Современные экспериментальные методы – рентгеноструктурный анализ, наблюдения с помощью электронного микроскопа и другие – обогатили наши представления о строении вещества. В газе между молекулами относительно большие расстояния, силы притяжения ничтожно малы. Молекулы газа стремятся всегда равномерно распределиться по всему занимаемому им объему. Газ оказывает давление на стенки сосуда, в котором он находится. Это давление обусловлено ударами движущихся молекул. При изучении кинетической теории газа рассматривают так называемый идеальный газ. Газ, в котором пренебрегаем силами межмолекулярного взаимодействия и объемом молекул газа. Считая, что при соударениях молекулы идеального газа представляют собой как абсолютно упругие шарики.
Дата добавления: 2017-06-13; просмотров: 1198;











