Основные газовые законы
Состояние некоторой массы m газа характеризуют основными параметрами: давлением P, температурой Т и объемом V. Эти термодинамические параметры тесно связаны. Процессы в газе, при которых меняются его параметры состояния, называются газовыми процессами. Газовые процессы, в которых один из параметров остается неизменным называются изопроцессами. Для идеальных газов справедливы следующие законы:
Закон Бойля-Мариотта. (Бойль – англ., 1662г.; Мариотт – франц., 1667г.)
Если Т = const данной массы газа (m = const), а давление P и V – объем изменяются. Процесс называется изотермическим. Для данной массы газа при постоянной температуре давление газа изменяется обратно пропорционально объему.PV = const Для двух состояний газа закон имеет вид: P1V1= P2V2, где P1иV1 - начальное состояние, P2иV2 - в конечном состоянии. Графически изотермический процесс представляется в виде гиперболы, называемой изотермой.
Р
Т = const
V, м 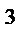
Законы Гей-Люссака. (1802 г.)Давление Р = const и m = const. Процесс изобарический.
Для данной массы газа при постоянном давлении объем газа изменяется линейно с температурой.
V
Р = const
V 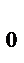
- 273 0 t, 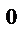 С
С
V 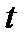 = V
= V 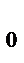 ( 1 + dt ),где V
( 1 + dt ),где V 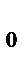 - объем при t = 0
- объем при t = 0 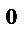 С;V
С;V 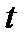 - объем газа при t;d – коэффициент объемного расширения; d = 1/273 град
- объем газа при t;d – коэффициент объемного расширения; d = 1/273 град 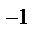 .Графически изобарический процесс представляет прямую.V/V0= T/T0При постоянном давлении объем газа пропорционален абсолютной температуре. ОбъемV = constиm = const. Процесс изохорический. Иногда этот закон называют закон Шарля. Для данной массы газа при постоянном объеме давление газа изменяется линейно с температурой.P
.Графически изобарический процесс представляет прямую.V/V0= T/T0При постоянном давлении объем газа пропорционален абсолютной температуре. ОбъемV = constиm = const. Процесс изохорический. Иногда этот закон называют закон Шарля. Для данной массы газа при постоянном объеме давление газа изменяется линейно с температурой.P 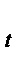 = P
= P 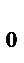 (1 + γt ),где P
(1 + γt ),где P 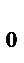 - давление при t = 0
- давление при t = 0 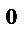 С;γ – термический коэффициент давления; γ = 1/273 град
С;γ – термический коэффициент давления; γ = 1/273 град 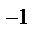 .Графически изохорический процесс представляет прямую.P/P0 =T/T0 «При постоянном объеме давление газа пропорционально абсолютной температуре».
.Графически изохорический процесс представляет прямую.P/P0 =T/T0 «При постоянном объеме давление газа пропорционально абсолютной температуре».
Закон Дальтона (1801 г., англ.) Парциальным давлением газа, входящего в газовую смесь, называется давление, которое имел бы этот газ, если бы он один занимал весь объем, представленной смеси. Давление газовой смеси равно сумме парциальных давлений входящих в нее газов.P = P1 + P2 + P3 + P4 + … + Pn
Закон Авогадро (итал., 1811 г.)При одинаковых температуре и давлении моли любых газов занимают одинаковые объемы. При нормальных условиях (температура 273,16 К и давлении 1,0133 Па) этот объем равен 22,41 м3/ моль.
Дата добавления: 2017-06-13; просмотров: 1094;











