Физико-химические основы процессов производства стали
При изучении основ производства стали используют следующие основные понятия и законы.
Объектом любого исследования является система. Системой называется совокупность (группа) тел, находящихся во взаимодействии. Система может быть однородной (гомогенной) и неоднородной (гетерогенной). В однородной системе нет поверхностей раздела. Газовая атмосфера рабочего пространства любого металлургического агрегата состоит из нескольких компонентов (N2, О2, СО, СО2, Н2О и др.). Однако она может служить примером однородной системы, так как представляет собой газовую смесь с одинаковым составом и свойствами в любой точке системы и не имеет поверхностей раздела.
Неоднородная система характеризуется наличием отдельных составляющих - фаз. В условиях сталеплавильного процесса металл, шлак, отходящие газы и футеровка составляют фазы неоднородной системы. Характеристикой системы служат параметры состояния. Параметры состояния - величины, определяющие состояние системы (объем, концентрация, давление, температура). Всякое изменение в системе, связанное с изменением параметров состояния, называется процессом. Примером процесса может служить любая химическая реакция в сталеплавильном агрегате. Химические реакции при выплавке чугуна и стали проходят преимущественно в расплавах.
В металлургии процессы обычно протекают в трех фазах либо во взаимодействии между ними: металлической, шлаковой и газовой. Чтобы показать, в какой фазе находятся вещества, принято их обозначения заключать в скобки: [ ], ( ) или { }, что соответствует металлической, шлаковой и газовой фазам соответственно. Например, [Мп] + [О] = (МпО) означает, что реакция происходит между марганцем и кислородом, растворенными в металле, с образованием оксида марганца, переходящего в шлак.
Все химические реакции проходят с выделением (экзотермические) или поглощением (эндотермические) теплоты. Теплоту, выделяющуюся или поглощающуюся при химических реакциях, называют тепловым эффектом (Q). Тепловой эффект экзотермических реакций имеет знак плюс, эндотермических - минус.
Все химические реакции делят на обратимые и необратимые. Необратимой реакцией называют реакцию, при которой исходные вещества практически полностью превращаются в продукты реакции. Обратимой называют реакцию, которая в зависимости от условий может протекать одновременно как в прямом, так и в обратном направлении. Обратимые реакции не допускают полного расходования любого из реагирующих веществ. Они протекают до установления химического равновесия. В обратимой реакции скорость прямого и обратного процессов равны между собой. Под скоростью химической реакции подразумевается изменение концентрации вещества (увеличение или уменьшение) в единицу времени.
Остановимся на некоторых физико-химических законах, которыми необходимо руководствоваться при анализе явлений, протекающих в сталеплавильной ванне.
Закон действующих масс. Работами Н. Н. Бекетова, математика Гульдберга и химика Вааге (1867 г.) было установлено, что скорость реакции пропорциональна концентрации реагирующих веществ. Так, для обратимой реакции аА + вВ ↔ сС + dD выражения для скоростей прямой и обратной реакции имеют следующий вид:
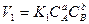 ,
, 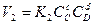 ,
,
где К1 и К2 - константы скоростей прямой и обратной реакций, 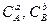 ,
, 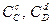 - концентрации реагирующих веществ.
- концентрации реагирующих веществ.
Равновесие данной реакции наступает в том случае, когда 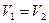 или
или 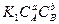 =
= 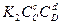 . Отсюда
. Отсюда 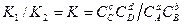 , где K - константа равновесия реакции, зависящая только от температуры и природы веществ.
, где K - константа равновесия реакции, зависящая только от температуры и природы веществ.
Концентрации газообразных веществ могут заменяться соответствующими парциальными давлениями.
Например, для реакции [С] + [О] = {СО} константа равновесия должна быть записана 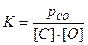 , где рCO - парциальное давление газа СО; [С], [О] - концентрации углерода и кислорода, растворенных в металле.
, где рCO - парциальное давление газа СО; [С], [О] - концентрации углерода и кислорода, растворенных в металле.
Принцип смещения равновесия (принцип Ле-Шателье). Если на систему, находящуюся в устойчивом равновесии, произведено внешнее воздействие (изменено одно из условий, определяющих равновесие: температура, давление, концентрация), то в системе возникают такие процессы, которые уменьшают эффект данного воздействия и приводят систему к новому состоянию устойчивого равновесия.
При повышении температуры равновесная реакция, протекающая с поглощением тепла, сдвигается в сторону увеличения продуктов реакции. Понижение температуры сдвигает реакцию в сторону увеличения концентраций реагирующих веществ. Для реакции, протекающей с выделением тепла, закономерности будут противоположными. Влияние давления на смещение равновесия химической реакции зависит от количества газообразных молекул в левой и правой частях уравнения реакции. Повышение давления вызывает сдвиг равновесия химической реакции в сторону уменьшения числа газообразных молей. Если реагирующие вещества и продукты реакции занимают одинаковый объем (реакция идет без изменения числа газообразных молей), то изменение давления не вызывает сдвига равновесия.
Закон распределения. Для металлургии закон распределения имеет большое практическое значение. Суть его заключается в следующем. Если в систему, состоящую из двух несмешивающихся жидкостей, т. е. представляющую собой два жидких слоя, ввести небольшое количество третьего компонента, способного растворяться в обеих жидкостях, то он распределяется между ними в соответствии с законом распределения. Отношение концентраций третьего компонента в двух жидких фазах, находящихся в равновесии, для данной температуры является величиной постоянной. Примером такой системы может служить металлическая ванна, шлак и растворенные в них элементы (Si; Мn; S; Р; О2 и т. д.). Применительно к этой металлургической системе закон распределения можно представить выражением L = (М)/[M], где L - коэффициент распределения; (М) и [М] - концентрации элемента в шлаке и металле соответственно. Закон распределения лежит в основе процессов удаления кислорода, серы, фосфора из жидкого металла в шлак при производстве стали. Любые способы снижения их концентрации в шлаке (скачивание шлака, связывание в прочные химические соединения и т. п.) должны привести к уменьшению их содержания в стали.
Дата добавления: 2017-06-13; просмотров: 2511;











